Hibridisasi adalah proses pembentukan orbital karena adanya gabungan dua atau lebih orbital atom dalam suatu satuan atom. Hibridisasi terjadi sebagai bentuk penyetaraan tigkat energi melalui penggabungan antar orbital senyawa kovalen atau kovalen koordinasi. Hibridisasi hanya dapat terjadi antara orbital-orbital dengan tingkat energi yang tidak berbeda jauh. Hibridisasi umunya tidak memerlukan tambahan energi. Tingkat energi orbital hibrida selalu terletak antara tingkat energi orbital-orbital asalnya. Bentuk molekul suatu senyawa dipengaruhi oleh bentuk orbital hibridanya.
Proses hibridisasi untuk senyawa PCl5 digambarkan melalui cara berikut.
Konfigurasi elektron 15P=1s2 2s2 2p6 3s2 3p3
Konfigurasi elektron 17Cl=1s2 2s2 2p6 3s2 3p5
Atom P akan berikatan dengan 5 buah atom Cl, maka atom P harus menyediakan 5 orbital yang terisi setengah penuh untuk elektron dari atom Cl. Agar tersedia 5 orbital yang masing-masing berisi 1 elektron, atom P harus membuka orbital d, serta 1 elektron harus berpindah dari 3s ke orbital 3d sehingga orbital 3d terisi 1 buah elektron tidak berpasangan.
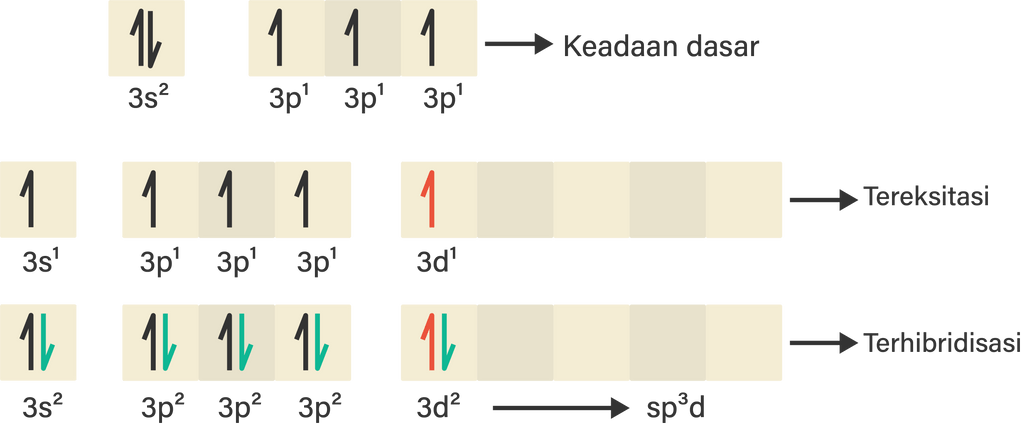
Berdasarkan gambar di atas dapat dilihat pada kondisi tereksitasi, 1 buah elektron dari orbital 3s berpindah ke orbital 3d yang ditunjukkan dengan warna merah. Setelah tersedia 5 buah orbital yang terisi setengah penuh, maka 5 buah elektron dari atom Cl (warna hijau) dapat menempati orbital-orbital hibrida tersebut. Dengan demikian, maka jenis hibridisasi yang terbentuk pada senyawa PCl5 adalah sp3d.
Jadi, hibridisasi yang terjadi pada atom pusat senyawa PCl5 adalah sp3d.
















