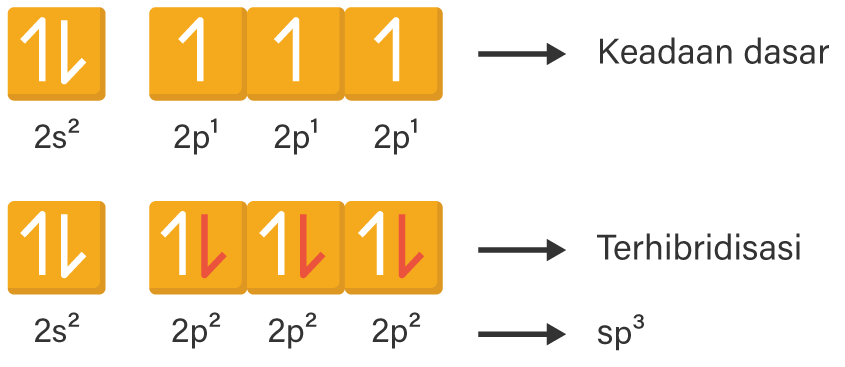Hibridisasi adalah proses pembentukan orbital karena adanya gabungan dua atau lebih orbital atom dalam suatu satuan atom. Hibridisasi terjadi sebagai bentuk penyetaraan tigkat energi melalui penggabungan antar orbital senyawa kovalen atau kovalen koordinasi. Hibridisasi hanya dapat terjadi antara orbital-orbital dengan tingkat energi yang tidak berbeda jauh. Hibridisasi umunya tidak memerlukan tambahan energi. Tingkat energi orbital hibrida selalu terletak antara tingkat energi orbital-orbital asalnya. Bentuk molekul suatu senyawa dipengaruhi oleh bentuk orbital hibridanya.
Proses hibridisasi untuk senyawa NH3 digambarkan melalui cara berikut.
Konfigurasi elektron 7N=1s2 2s2 2p3
Konfigurasi elektron 1H=1s1
Atom N akan berikatan dengan 3 buah atom H, maka atom C harus menyediakan 3 orbital yang terisi setengah penuh untuk elektron dari atom H. Jika dibuat gambaran orbital elektronnya, maka pada orbital 2p telah tersedia 3 orbital yang terisi dengan masing-masing 1 elektron untuk ditempati elektron atom H, sehingga tidak perlu ada perpindahan elektron (eksitasi) dari orbital 2s.
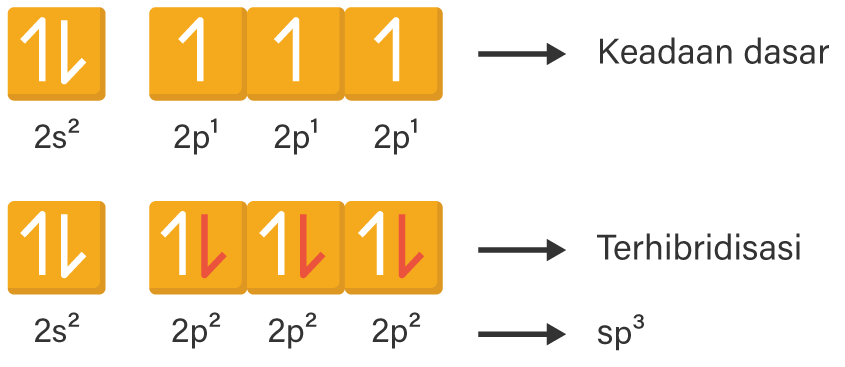
Berdasarkan gambar di atas dapat terlihat jika tidak ada elektron dari orbital 2s yang berpindah ke orbital 2p atau tidak terjadi eksitasi elektron. Karena telah tersedia 3 buah orbital yang terisi setengah penuh, maka 3 buah elektron dari atom H (warna merah) dapat menempati orbital-orbital hibrida tersebut. Dengan demikian, maka jenis hibridisasi yang terbentuk pada senyawa NH3 adalah sp3.
Jadi, hibridisasi yang terjadi pada atom pusat senyawa NH3 adalah sp3.