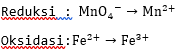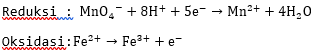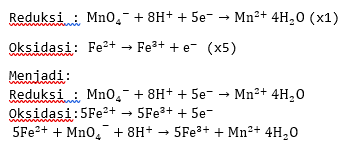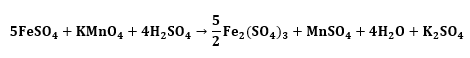Metode ion elektron atau setengah reaksi berdasarkan prinsip bahwa jumlah elektron yang dilepaskan pada setengah reaksi oksidasi sama dengan jumlah elektron yang diserap pada setengah reaksi reduksi. Penyetaraan persamaan redoks ini berlangsung dalam suasana asam maupun basa. Pada soal terdapat ion  yang menandakan bahwa reaksi terjadi pada suasana asam.
yang menandakan bahwa reaksi terjadi pada suasana asam.
Langkah-langkah Penyetaraan reaksi redoks dengan metode setengah reaksi dalam suasana asam:
1. Tentukan setengah reaksi oksidasi dan reduksi pada zat yang mengalami perubahan bilangan oksidasi. Reaksinya dibuat dalam bentuk ionnya.
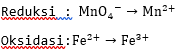
2. Samakan jumlah unsur selain O dan H agar jumlah unsur tersebut di kiri dan kanan sama banyak,
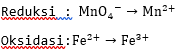
3. Sisi yang kekurangan oksigen ditambahkan  sebanyak atom O yang kurang, sisi yang kekurangan hidrogen ditambahkan ion
sebanyak atom O yang kurang, sisi yang kekurangan hidrogen ditambahkan ion  sebanyak atom H yang kurang.
sebanyak atom H yang kurang.

4. Menyamakan muatan ruas kiri dan ruas kanan dengan menambahkan elektron.
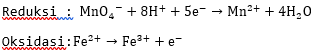
5. Menyamakan jumlah elektron pada reaksi oksidasi dan reduksi, kemudian menjumlahkan setengah reaksi oksidasi dengan setengah reaksi reduksi dan pada akhir reaksi jumlah elektron dihilangkan.
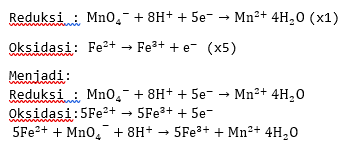
7. Tuliskan dalam bentuk reaksi sempurnanya.
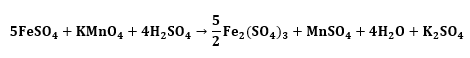
8. Sederhanakan koefisien reaksi.

Setelah reaksinya setara, mol  dapat dihitung menggunakan rumus :
dapat dihitung menggunakan rumus :

Sehingga didapatkan mol KMnO4 sebanyak 0,01 mol dari hasil perbandingan koefisien KMnO4 dengan FeSO4.
Maka, volume KMnO4 dapat dihitung dengan menggunakan rumus :

Jadi, banyaknya KMnO4 0,4 M yang diperlukan untuk mengoksidasi 7,60 gram FeSO4 adalah 25 mL.