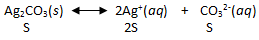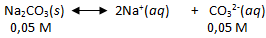Iklan
Pertanyaan
Kelarutan Ag 2 CO 3 dalam larutan Na 2 CO 3 0,05 M adalah 1 , 8 × 1 0 − 3 gram/liter. Hitunglah tetapan hasil kali kelarutan Ag 2 CO 3 tersebut? (Ar Ag = 108; C = 12; O = 16)
Kelarutan dalam larutan 0,05 M adalah gram/liter. Hitunglah tetapan hasil kali kelarutan tersebut? (Ar = 108; = 12; = 16)
Iklan
EB
E. Bintang
Master Teacher
Mahasiswa/Alumni Universitas Negeri Yogyakarta
Jawaban terverifikasi
2
5.0 (2 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia