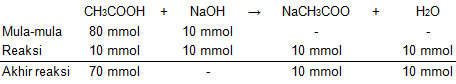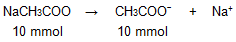pH larutan tersebut adalah 4,15.
Asam asetat (CH3COOH) merupakan asam lemah, sedangkan natrium hidroksida (NaOH) merupakan basa kuat. Campuran antara asam lemah dengan basa kuat akan membentuk larutan penyangga asam jika asam lemah sisa.
Untuk mengetahui pH campuran 0,4 gram NaOH dengan 200 mL larutan CH3COOH 0,4 M, perlu dihitung dengan cara berikut:
1. Menentukan mol mula-mula CH3COOH dan NaOH
mol CH3COOHmol NaOH=======[CH3COOH]×volume CH3COOH0,4 M×200 mL80 mmolMr NaOHmassa NaOH40 gr.mol−10,4 gr0,01 mol10 mmol
2. Menentukan mol basa konjugasi 
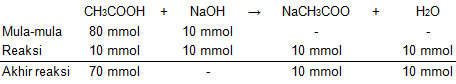
Dari tabel di atas, mol CH3COOH sisa adalah 70 mmol dan mol NaCH3COO yang terbentuk adalah 10 mmol, sehingga mol basa konjugasinya dapat dihitung sebagai berikut:
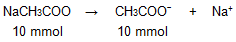
Dari persamaan reaksi di atas, dapat diketahui bahwa koefisien NaCH3COO sama dengan koefisien CH3COO−, sehingga mol NaCH3COO sama dengan mol CH3COO−, yaitu 10 mmol.
3. Menentukan konsentrasi ion 
[H+][H+][H+]===Ka×mol CH3COO−mol CH3COOH sisa10−5 M×10 mmol70 mmol7×10−5 M
4. Menentukan pH larutan
pH====−log [H+]−log (7×10−5)5−log 74,15
Dari perhitungan di atas, dapat diketahui bahwa pH larutan penyangga tersebut adalah 4,15.