Salah satu konsep dari reaksi redoks adalah perubahan bilangan oksidasi. Pengertian reaksi redoks berdasarkan perubahan biloks adalah sebagai berikut:
- Reduksi merupakan reaksi karena adanya penurunan bilangan oksidasi.
- Oksidasi merupakan reaksi karena adanya peningkatan bilangan oksidasi.
Selain itu pada reaksi redoks terdapat istilah yang disebut dengan reduktor dan oksidator.
- Reduktor merupakan zat yang mengalami oksidasi.
- Oksidator merupakan zat yang mengalami reduksi.

Unsur O: bilangan oksidasi O sebesar -2, kecuali pada peroksida, superoksida, dan unsur bebas. Tidak ada peroksida, superoksida, dan unsur bebas, berarti atom O tidak mengalami perubahan bilangan oksidasi.
Unsur Mn: ada di  dan
dan  .
.
 :
:

 :
:

Dengan demikian, Mn mengalami kenaikan bilangan oksidasi dari +2 ke +7 (oksidasi) sehingga  merupakan reduktor.
merupakan reduktor.
Unsur Pb: ada di  dan
dan 
 :
:

 : bilangan oksidasi ion tunggal sama dengan muatannya sehingga bilangan oksidasi Pb sebesar +2.
: bilangan oksidasi ion tunggal sama dengan muatannya sehingga bilangan oksidasi Pb sebesar +2.
Dengan demikian, Pb mengalami penurunan bilangan oksidasi dari +4 ke +2 (reduksi) sehingga  merupakan oksidator.
merupakan oksidator.

Unsur O: bilangan oksidasi O sebesar -2, kecuali pada peroksida, superoksida, dan unsur bebas. Tidak ada peroksida, superoksida, dan unsur bebas, berarti atom O tidak mengalami perubahan bilangan oksidasi.
Unsur Zn: ada di  dan unsur bebas Zn.
dan unsur bebas Zn.
 :
:

Sebagai unsur bebas, bilangan oksidasi Zn sebesar 0.
Dengan demikian, Zn mengalami penurunan bilangan oksidasi dari +2 ke 0 (reduksi) sehingga  merupakan oksidator.
merupakan oksidator.
Unsur C: ada di unsur bebas C dan  .
.
Sebagai unsur bebas, bilangan oksidasi C sebesar 0.
 :
:

Dengan demikian, C mengalami penurunan bilangan oksidasi dari 0 ke +4 (oksidasi) sehingga C merupakan reduktor.
Jadi, kesimpulan jawaban untuk soal di atas adalah:
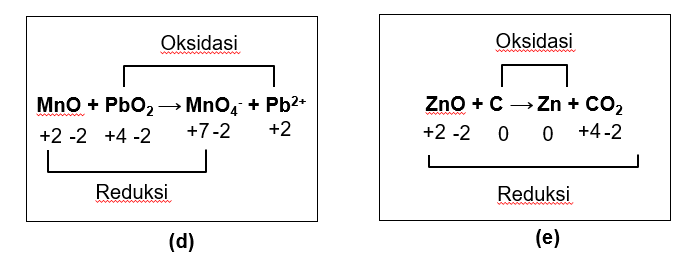
d. Oksidatornya adalah  dan reduktornya adalah
dan reduktornya adalah  .
.
e. Oksidatornya adalah  dan reduktornya adalah C.
dan reduktornya adalah C.
















