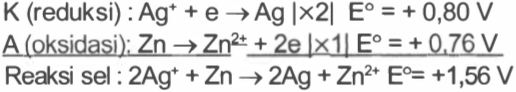Iklan
Pertanyaan
Suatu sel volta terdiri dari elektroda Ag yang dicelupkan di dalam larutan Ag + 1 M dan elektroda Zn yang dicelupkan ke dalam larutan Zn 2 + 1 M. Bila diketahui, Ag + + e Zn 2 + + 2 e → → Ag E ∘ = + 0 , 80 volt Zn E ∘ = − 0 , 76 volt Maka pernyataan di bawah ini yang benar, kecuali ...
Suatu sel volta terdiri dari elektroda yang dicelupkan di dalam larutan 1 M dan elektroda yang dicelupkan ke dalam larutan 1 M. Bila diketahui,
Maka pernyataan di bawah ini yang benar, kecuali ...
elektroda bertindak sebagai katoda
elektroda bertindak sebagai anoda
potensial standar sel adalah
reaksi selnya adalah
logam mengendap pada elektroda
Iklan
B. Rohmawati
Master Teacher
Mahasiswa/Alumni Universitas Negeri Semarang
17
4.7 (28 rating)
Putri
Makasih ❤️
Kholilah
Pembahasan lengkap banget
Syifa nurul fadilah
Jawaban tidak sesuai
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia