Iklan
Pertanyaan
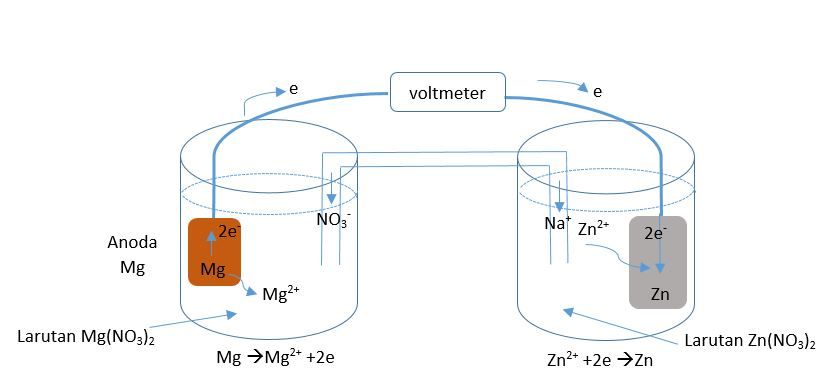
Suatu sel galvani dengan elektrode Mg ( s ) dicelupkan dalam larutan Mg ( NO 3 ) 2 ( a q ) dalam satu kompartemen dan elektrode Zn ( s ) dicelupkan dalam larutan Zn ( NO 3 ) 2 ( a q ) . Kedua elektroda dihubungkan dengan kawat dan jembatan garam NaNO 3 digunakan untuk menghubungkan kedua larutan, jika diketahui potensial reduksi: Mg 2 + ( a q ) + 2 e − → Mg ( s ) E ∘ = − 2 , 37 V Zn 2 + ( a q ) + 2 e − → Zn ( s ) E ∘ = − 0 , 76 V a. Gambarkan sel galvani tersebut!
Suatu sel galvani dengan elektrode dicelupkan dalam larutan dalam satu kompartemen dan elektrode dicelupkan dalam larutan . Kedua elektroda dihubungkan dengan kawat dan jembatan garam digunakan untuk menghubungkan kedua larutan, jika diketahui potensial reduksi:
a. Gambarkan sel galvani tersebut!
Iklan
SL
S. Lubis
Master Teacher
Jawaban terverifikasi
6
5.0 (2 rating)
ZH
Zeronic Heronic
Pembahasan lengkap banget
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia