Iklan
Pertanyaan
Perhatikan sel volta pada gambar di bawah dan tunjukkan mana yang menjadi: anode, katode, jembatan garam, elektrode sumber elektron, elektrodebermuatan positif, dan elektrode yang massanya bertambah ketika selvolta beroperasi
Perhatikan sel volta pada gambar di bawah dan tunjukkan mana yang menjadi:
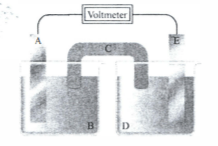
- anode,
- katode,
- jembatan garam,
- elektrode sumber elektron,
- elektrode bermuatan positif, dan
- elektrode yang massanya bertambah ketika sel volta beroperasi
Iklan
BR
B. Rohmawati
Master Teacher
Mahasiswa/Alumni Universitas Negeri Semarang
Jawaban terverifikasi
21
4.8 (9 rating)
KZ
Kayla Zalfa Amalia Putri
Ini yang aku cari! Pembahasan lengkap banget Makasih ❤️ Mudah dimengerti
C
Cahyaajisaputra
Pembahasan terpotong
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia















