Iklan
Pertanyaan
Perhatikan gambar sel volta di bawah. Ke arah mana elektron mengalir? Pada setengah-sel yang manakah oksidasi terjadi Pada setengah-sel yang manakah elektron memasuki sel? Pada elektrode yang mana elektron diterima? Elektrodemanakah yang bermuatan negatif? Elektrodemanakah yang massanya berkurang selama selberoperasi? Larutan apa yang dapat digunakan sebagai elektrolit? Garam apa yang dapat digunakan sebagai jembatan garam? Ke arah manakah ion-ion jembatan garamberpindah? Tuliskan reaksi redoks yang terjadi.
Perhatikan gambar sel volta di bawah.
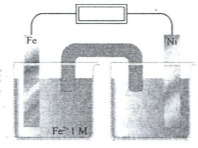
- Ke arah mana elektron mengalir?
- Pada setengah-sel yang manakah oksidasi terjadi
- Pada setengah-sel yang manakah elektron memasuki sel?
- Pada elektrode yang mana elektron diterima?
- Elektrode manakah yang bermuatan negatif?
- Elektrode manakah yang massanya berkurang selama sel beroperasi?
- Larutan apa yang dapat digunakan sebagai elektrolit?
- Garam apa yang dapat digunakan sebagai jembatan garam?
- Ke arah manakah ion-ion jembatan garam berpindah?
- Tuliskan reaksi redoks yang terjadi.
Iklan
SL
S. Lubis
Master Teacher
Jawaban terverifikasi
11
4.5 (6 rating)
LS
Lenti Sulestari
Pembahasan lengkap banget
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia















