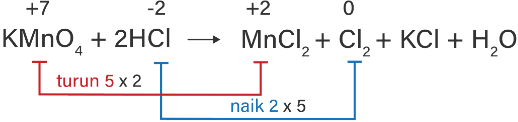Iklan
Pertanyaan
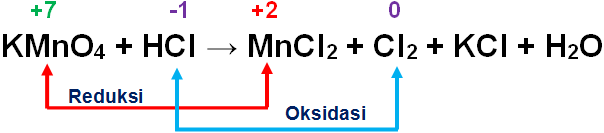
Setarakan persamaan-persamaan redoks berikut melalui cara bilangan oksidasi menurut reaksi molekul! KMnO 4 + HCl → MnCl 2 + Cl 2 + KCI + H 2 O
Setarakan persamaan-persamaan redoks berikut melalui cara bilangan oksidasi menurut reaksi molekul!
Iklan
SL
S. Lubis
Master Teacher
Jawaban terverifikasi
4
3.0 (2 rating)
FG
Fajar Ghibran
Jawaban tidak sesuai
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia