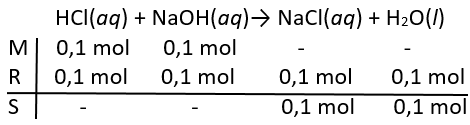Iklan
Pertanyaan
Sebanyak 100 mL larutan NaOH 1 M direaksikan dengan 100 mL larutan HCl 1 M dalam sebuah kalorimeter. Campuran tersebut menyebabkan perubahan suhu dari 2 9 ∘ C menjadi 37 , 5 ∘ C . Jikakalor jenis air dan massa jenis larutan dianggap 1 g mL -1 , persamaan termokimianya adalah ...
Sebanyak 100 mL larutan 1 M direaksikan dengan 100 mL larutan 1 M dalam sebuah kalorimeter. Campuran tersebut menyebabkan perubahan suhu dari menjadi . Jika kalor jenis air dan massa jenis larutan dianggap 1 g mL-1, persamaan termokimianya adalah ...
Iklan
IS
I. Solichah
Master Teacher
Jawaban terverifikasi
1
4.8 (8 rating)
pi
putri ida anggraini
makasih kk Mudah dimengerti Bantu banget
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia