Iklan
Pertanyaan
Perhatikan diagram sel berikut. a. Tentukan arah aliran elektronnya. b. Tentukan anode dan katodenya. c. Tuliskan reaksi di anode dan di katode. d. Tuliskan bagan selnya.
Perhatikan diagram sel berikut.
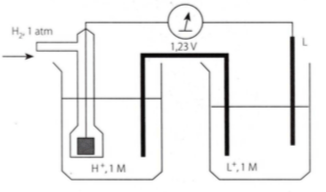
a. Tentukan arah aliran elektronnya.
b. Tentukan anode dan katodenya.
c. Tuliskan reaksi di anode dan di katode.
d. Tuliskan bagan selnya.
Iklan
SL
S. Lubis
Master Teacher
Jawaban terverifikasi
10
4.6 (6 rating)
A
Amelia
Makasih ❤️
d
dimasss
Bantu banget
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia















