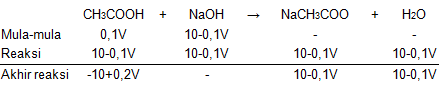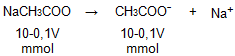Jawaban yang tepat adalah E.
Asam asetat (CH3COOH) merupakan asam lemah, sedangkan natrium hidroksida (NaOH) merupakan basa kuat. Campuran antara asam lemah dengan basa kuat akan membentuk larutan penyangga asam jika asam lemah sisa.
Untuk mengetahui perbandingan volume CH3COOH 0,1 M dan NaOH 0,1 M yang harus dicampurkan untuk membuat larutan buffer dengan pH = 6, perlu dihitung dengan cara berikut:
1. Menentukan mol mula-mula CH3COOH dan NaOH
Misal, volume total larutan adalah 100 mL, maka
volume CH3COOH = V mL
volume NaOH = (100 - V) mL
sehingga,
mol CH3COOHmol NaOH======[CH3COOH]×volume CH3COOH0,1 M×V mL0,1V mmol[NaOH]×volume NaOH0,1 M×(100−V) mL10−0,1V mmol
2. Menentukan mol basa konjugasi 
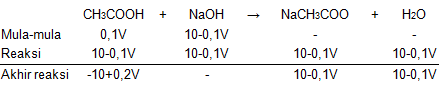
Dari tabel di atas, mol CH3COOH sisa adalah (-10+0,2V) mmol dan mol NaCH3COO yang terbentuk adalah (10-0,1V) mmol, sehingga mol basa konjugasinya dapat dihitung sebagai berikut:
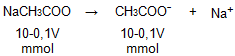
Dari persamaan reaksi di atas, dapat diketahui bahwa koefisien NaCH3COO sama dengan koefisien CH3COO−, sehingga mol NaCH3COO sama dengan mol CH3COO−, yaitu 10-0,1V mmol.
3. Menentukan konsentrasi ion 
pH[H+]==610−6 M
4. Menentukan volume CH3COOH dan NaOH
[H+]10−6 M10−5 M10−6 M×(10−0,1V)1−0,01V0,2V+0,01V0,21VV=======Ka×mol CH3COO−mol CH3COOH sisa10−5 M×(10−0,1V) mmol(−10+0,2V) mmol−10+0,2V−10+0,2V10+11152,38
Dari perhitungan di atas, dapat diketahui:
volume CH3COOH = V = 52,38 mL
volume NaOH = 100 - V = 100 - 52,38 = 47,62 mL
5. Menentukan perbandingan volume CH3COOH dan volume NaOH
volume NaOHvolume CH3COOH=47,62 mL52,38 mLvolume NaOHvolume CH3COOH=1011
Dari perhitungan di atas, dapat diketahui bahwa perbandingan volume CH3COOH dan volume NaOH adalah 11 : 10.