Iklan
Pertanyaan
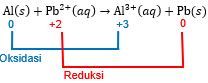
Pada kondisi standar, reaksi mana yang berlangsung spontan dan reaksi mana yang berlangsung tidak spontan? Jika tidak spontan, tuliskan reaksi yang spontan! AI ( s ) + Pb 2 + ( a q ) → Al 3 + ( a q ) + Pb ( s )
Pada kondisi standar, reaksi mana yang berlangsung spontan dan reaksi mana yang berlangsung tidak spontan? Jika tidak spontan, tuliskan reaksi yang spontan!
Iklan
NP
N. Puspita
Master Teacher
Jawaban terverifikasi
26
4.7 (20 rating)
FI
Fransisca Ina Wahyu Winata
Makasih ❤️
SA
Shalmayra Alya Qonita
Makasih ❤️
E
Egawahyu
Pembahasan lengkap banget
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia