Iklan
Pertanyaan
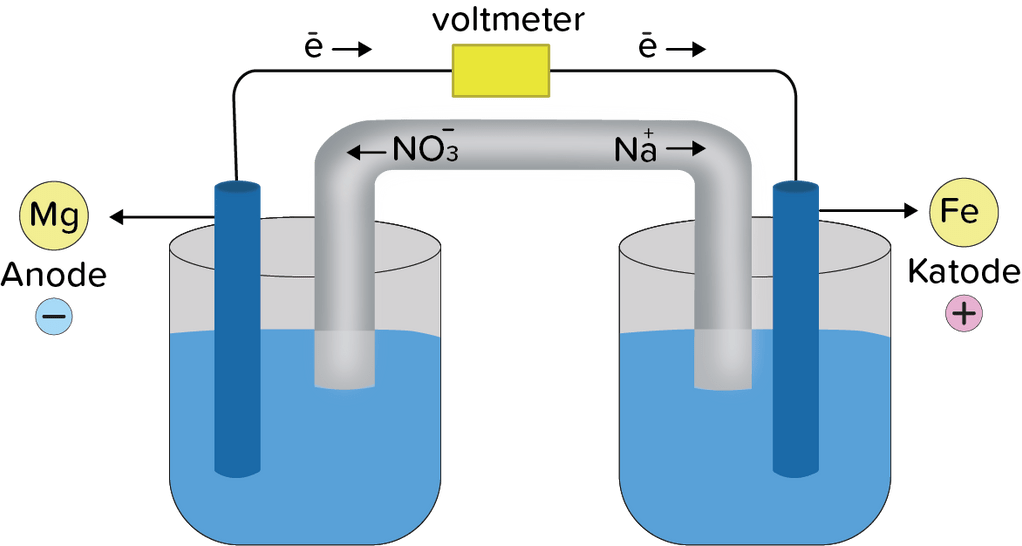
Dengan hanya melihat deret besarya E°tanpa menghitung perkirakan apakahtiap reaksi redoks berikut dapat berlangsung spontan. Jika reaksi berlangsung spontan sebagaimana yang tertulis, buatlah diagram sel elektrokimia terjadinya reaksi. Jika reaksi tidak berlangsung spontan sebagaimana tertulis,tuliskan persamaan reaksi spontannya di mana reaksi dapat berlangsung dan gambarkan diagram sel elektrokimianya. Tuliskan label pada anode, katode, dan arahaliran elektronnya! Fe ( s ) + Mg 2 + ( a q ) → Fe 2 + ( a q ) + Mg ( s )
Dengan hanya melihat deret besarya E° tanpa menghitung perkirakan apakah tiap reaksi redoks berikut dapat berlangsung spontan. Jika reaksi berlangsung spontan sebagaimana yang tertulis, buatlah diagram sel elektrokimia terjadinya reaksi. Jika reaksi tidak berlangsung spontan sebagaimana tertulis, tuliskan persamaan reaksi spontannya di mana reaksi dapat berlangsung dan gambarkan diagram sel elektrokimianya. Tuliskan label pada anode, katode, dan arah aliran elektronnya!
Iklan
G. Suprobo
Master Teacher
Mahasiswa/Alumni Institut Pertanian Bogor
1
5.0 (6 rating)
Shalmayra Alya Qonita
Pembahasan lengkap banget
Asyffa
Ini yang aku cari! Bantu banget Makasih ❤️ Mudah dimengerti
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia