pH merupakan derajat keasaman suatu larutan yang biasanya ditentukan melalui negatif logaritma dari konsentrasi H+ maka untuk menentukan pH perlu dicari terlebih dahulu konsentrasi H+ untuk asam ataupun konsentrasi OH− untuk basa. Maka untuk menyelesaikan soal ini caranya adalah.
a. pH masing-masing larutan sebelum dicampur
Langkah 1 mencari pH 10 mL H2SO4 0,1 M.
[H+]pH======a×Ma2×0,1 M0,2 M−log [H+]−log (2×10−1)1−log 2
Langkah 2. Menghitung pH 15 mL KOH 0,1 M.
Untuk menentukan pH basa maka perlu dicari terlebih dahulu pOH, karena terdapat hubungan pH dan pOH sebagai berikut pada suhu 25 ∘C
14 = pH + pOH
Sehingga tentukan terlebih dahulu konsentrasi OH− untuk basa tersebut dan menghitung pOHnya seperti berikut.
[OH−]pOH======b×Mb1×0,110−1−log [OH−]− log (10−1)1
Kemudian hitung pH larutan basa kuat tersebut dengan cara.
1414pH===pH+pOHpH+113
Jadi, berdasarkan perhitungan tersebut pH awal asam sulfat adalah 1 - log 2 dan pH awal KOH adalah 13.
b. pH campuran
Untuk menentukan pH campuran maka perlu dihitung terlebih dahulu mol spesi yang tersisa setelah reaksi, caranya dengan menghitung mol asam kuat dan basa kuat mula-mula.
mol asammol basa======Ma×Va0,1 M×10 mL1 mmolMb×Vb0,1 M×15 mL1,5 mmol
kemudian masukan pada matriks MRS seperti berikut ini.
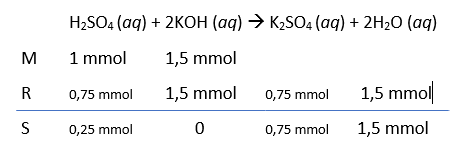
Berdasarkan perhitungan pada matriks spesi yang tersisa adalah asam kuat sehingga untuk mengetahui pH-nya kita perlu menghitung konsentrasi asam kuat H2SO4 pada keadaan akhir sebagai berikut.
Ma====volume campuranmol asam25 mL0,25 mmol0,01 M10−2 M
Kemudian hitung konsentrasi H+ dan pH larutan asam kuat dengan cara berikut
[H+]pH=====a×Ma2×10−2−log [H+]− log (2×10−2)2−log 2
Berdasarkan perhitungan tersebut, maka pH larutan setelah dicampurkan adalah 2 - log 2.