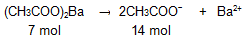pH larutan tersebut adalah 5,59.
CH3COOH merupakan asam lemah, sedangkan CH3COOBa merupakan garam yang mengandung basa konjugasi dari CH3COOH, yaitu CH3COO−. Campuran antara asam lemah dengan basa konjugasi yang berasal dari garamnya akan membentuk larutan penyangga asam.
Dalam soal tertulis barium asetat dengan rumus molekul CH3COOBa, namun hal tersebut adalah salah. Rumus barium asetat yang benar adalah (CH3COO)2Ba.
Untuk mengetahui pH larutan dari campuran larutan CH3COOH dengan (CH3COO)2Ba dengan perbandingan 2 : 7, maka perlu dihitung dengan cara berikut:
1. Menentukan mol mula-mula CH3COOH dan (CH3COO)2Ba
CH3COOH : (CH3COO)2Ba == 2 : 72 mol : 7 mol
2. Menentukan mol basa konjugasi 
Perhatikan persamaan reaksi berikut:
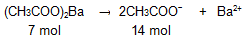
Dari persamaan reaksi di atas, dapat diketahui bahwa koefisien CH3COO− adalah 2 kali dari koefisien (CH3COO)2Ba, sehingga mol CH3COO− adalah 2 kali mol (CH3COO)2Ba, yaitu 14 mol.
3. Menentukan konsentrasi ion 
Ka CH3COOH=1,8×10−5, sehingga
[H+]===Ka×mol CH3COO−mol CH3COOH1,8×10−5 M×14 mol2 mol2,6×10−6 M
4. Menentukan pH larutan
pH====−log [H+]−log (2,6×10−6)6−log 2,65,59
Dari perhitungan di atas, dapat diketahui bahwa pH larutan penyangga tersebut adalah 5,59.