Iklan
Pertanyaan
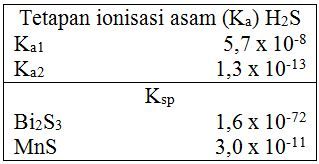
Hidrogen sulfida H 2 S , dapat digunakan untuk mengendapkan ion-ion logamsecara selektif melalui pengontrolan p H larutan. Gunakan data berikut untuk menjawab pertanyaan-pertanyaanyang terkait. Tuliskan persamaan reaksi kesetimbangan tahap-tahap ionisasi H 2 S . Tuliskan pernyataan tetapan kesetimbangan ionisasi total H 2 S menjadi 2 H + dan S 2 − dan tentukan nilai tetapan kesetimbangannya. Untuk larutan dengan [ H 2 S ] = 0,10M, [ Bi 3 + ]= [ Mn 2 + ]= 1,50 M dan [ H + ] = 10,00 M, tentukan garam sulfida yang mengendap terlebih dahulu dan hitunglah persen larutan garam ini yang masih tertinggal dalam larutan jenuh. p H larutan akan terus bertambah hingga logam berikutnya mengendap sebagai garam sulfida. Tentukan p H larutan pada saat garam yang kedua mulai mengendap.
Hidrogen sulfida , dapat digunakan untuk mengendapkan ion-ion logam secara selektif melalui pengontrolan larutan. Gunakan data berikut untuk menjawab pertanyaan-pertanyaan yang terkait.
- Tuliskan persamaan reaksi kesetimbangan tahap-tahap ionisasi .
- Tuliskan pernyataan tetapan kesetimbangan ionisasi total menjadi dan dan tentukan nilai tetapan kesetimbangannya.
- Untuk larutan dengan [] = 0,10 M, [] = [] = 1,50 M dan [] = 10,00 M, tentukan garam sulfida yang mengendap terlebih dahulu dan hitunglah persen larutan garam ini yang masih tertinggal dalam larutan jenuh.
- larutan akan terus bertambah hingga logam berikutnya mengendap sebagai garam sulfida. Tentukan larutan pada saat garam yang kedua mulai mengendap.
Iklan
BR
B. Rohmawati
Master Teacher
Mahasiswa/Alumni Universitas Negeri Semarang
Jawaban terverifikasi
1
0.0 (0 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia