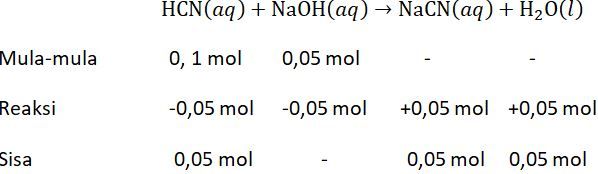Iklan
Pertanyaan
Asam sianida (HCN) adalah gas yang larut dalam air dan bersifat asam lemah dengan nilai tetapan kesetimbangan K a HCN = 4 , 9 × 1 0 − 10 . Tuliskan reaksi kesetimbangan HCN dalam air. Berapa pH dari 1 liter larutan HCN 0,1 M. Ke dalam 1 L larutan HCN 0,1 N ditambahkan 2 g NaOH (40 g/mol). Komponen pereaksi dan produk reaksi apa yang ada setelah reaksi? Hitunglah pH larutan tersebut setelah ditambahkan 2 gram NaOH. Apakah campuran HCN dengan CN − yang diperoleh dapat digunakan sebagai larutan penyangga asam? Mengapa demikian? Dari analisis kasus ini, asam lemah dengan nilai K a berapa yang cocok untuk membuat larutan penyangga asam?
Asam sianida (HCN) adalah gas yang larut dalam air dan bersifat asam lemah dengan nilai tetapan kesetimbangan .
- Tuliskan reaksi kesetimbangan HCN dalam air.
- Berapa pH dari 1 liter larutan HCN 0,1 M.
- Ke dalam 1 L larutan HCN 0,1 N ditambahkan 2 g NaOH (40 g/mol). Komponen pereaksi dan produk reaksi apa yang ada setelah reaksi?
- Hitunglah pH larutan tersebut setelah ditambahkan 2 gram NaOH.
- Apakah campuran HCN dengan yang diperoleh dapat digunakan sebagai larutan penyangga asam? Mengapa demikian?
- Dari analisis kasus ini, asam lemah dengan nilai berapa yang cocok untuk membuat larutan penyangga asam?
Iklan
Q'
Q. 'Ainillana
Master Teacher
Mahasiswa/Alumni Universitas Negeri Yogyakarta
Jawaban terverifikasi
1
5.0 (2 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia