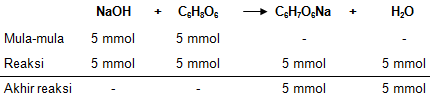Iklan
Pertanyaan
Asam askorbat ( C 6 H 8 0 6 ) adalah asam lemahdan terionisasi mengikuti tahapan berikut: C 6 H 8 O 6 ⇄ C 6 H 7 O 6 − + H + Ka 1 = 6 , 8 × 1 0 − 5 C 6 H 7 O 6 − ⇄ C 6 H 6 O 6 + H + Ka 2 = 2 , 7 × 1 0 − 12 Asam askorbat dapat dititrasi dengan NaOH menurut tahap disosiasi pertama ( Ka 1 ) Jika 50 cm 3 asam askorbat 0,1 M dititrasi dengan NaOH 0,2 M,dalam perhitungan berikut dapat diabaikan tahapdisosiasi kedua. Diketahui log 1,65 = 0,21. Derajat keasaman pada titik ekuivalensebesar ....
Asam askorbat adalah asam lemah dan terionisasi mengikuti tahapan berikut:
Asam askorbat dapat dititrasi dengan menurut tahap disosiasi pertama Jika asam askorbat 0,1 M dititrasi dengan 0,2 M, dalam perhitungan berikut dapat diabaikan tahap disosiasi kedua. Diketahui log 1,65 = 0,21.
Derajat keasaman pada titik ekuivalen sebesar ....
7,00
8,50
8,35
8,58
9,37
Iklan
Q'
Q. 'Ainillana
Master Teacher
Mahasiswa/Alumni Universitas Negeri Yogyakarta
Jawaban terverifikasi
1
5.0 (1 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia