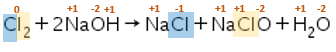Reaksi disproporsionasi adalah reaksi redoks yang melibatkan satu spesi pada ruas kiri (pereaksi) sedangkan pada reaksi konproporsionasi merupakan reaksi redoks yang melibatkan satu spesi pada ruas kanan (produk). Contoh reaksi disproporsionasi adalah:
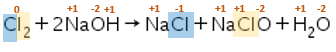
dan contoh reaksi konproporsionasi adalah:
2H2S+SO2→3S+2H2O.
Reaksi disproporsionasi dan reaksi konproposionasi adalah reaksi redoks spesial yang tergolong dalam reaksi autoredoks, yaitu reaksi reduksi dan oksidasi yang hanya melibatkan satu spesi. Pada reaksi disproporsionasi satu spesi yang terlibat ada pada ruas kiri (pereaksi) sedangkan pada reaksi konproporsionasi satu spesi yang terlibat ada pada ruas kanan (produk). Dengan kata lain, reaksi disproporsionasi adalah reaksi redoks dengan spesi yang mengalami oksidasi sama dengan yang mengalami reduksi. Sedangkan reaksi konproporsionasi adalah reaksi redoks dengan spesi hasil oksidasi sama dengan spesi hasil reduksi. Berikut adalah contoh dari reaksi disproporsionasi dan reaksi konproposionasi:
Contoh reaksi disproporsionasi:
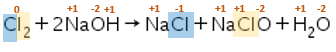
Unsur Cl pada spesi Cl2 memiliki bilangan oksidasi 0 karena merupakan unsur bebas, unsur Cl pada NaCl memiliki bilangan oksidasi -1 dan unsur Cl pada NaClO memiliki bilangan oksidasi +1. Unsur Cl pada spesi Cl2 mengalami reaksi reduksi dengan unsur Cl pada NaCl dan juga mengalami reaksi oksidasi dengan unsur Cl pada NaClO.
Contoh reaksi konproporsionasi:
2H2S+SO2→3S+2H2O
Unsur S pada spesi H2S memiliki bilangan oksidasi -2, unsur S pada SO2 memiliki bilangan oksidasi +4 dan unsur S pada ruas kanan memiliki bilangan oksidasi 0 karena merupakan unsur bebas. Unsur S pada ruas kanan mengalami reaksi reduksi dengan unsur S pada H2S dan juga mengalami reaksi oksidasi dengan unsur S pada SO2.