Bentuk molekul menentukan sifat kepolaran senyawa kovalen. Jika di dalam molekul terdapat pemisahan muatan maka kerapatan elektron dalam molekul tidak merata sehingga molekul bersifat polar. Sebaliknya, jika kerapatan elektron tersebar merata maka molekul bersifat nonpolar. Senyawa kovalen polar berubah menjadi nonpolar jika molekulnya berbentuk simetris. Hal itu terjadi karena muatan positif berimpit dengan muatan negatif. Jika muatan tidak simetris, pusat muatan positif dan negatif menjadi terpisah sehingga molekul bersifat polar.
Sebelum dapat menentukan bentuk molekul dan kepolaran suatu senyawa, maka perlu dibuat terlebih dahulu struktur Lewis dan ditentukan tipe molekulnya berdasarkan notasi A, X, dan E. Senyawa-senyawa yang memiliki PEB dirumuskan dengan notasi A, X, E, dengan A sebagai atom pusat, X sebagai pasangan elektrom berikatan (PEI), dan E adalah pasangan elektron bebas (PEB).
Untuk dapat menjawab soal di atas, maka terlebih dahulu dibuat konfigurasi elektron dari atom F (nomor atom = 9) dan atom M (nomor atom = 54) agar dapat dibuat struktur Lewisnya. Konfigurasi elektron unsur M dan F adalah sebagai berikut.
9F54M==1s2 2s2 2p5[36Kr] 5s2 4d10 5p6
Berdasarkan konfigurasi elektron di atas, diketahui bahwa atom F memiliki elektron valensi sebanyak 7 dan atom M memiliki elektron valensi sebanyak 8. Pada senyawa MF4, masing-masing atom F menggunakan sebuah elektron dari atom M secara bersama untuk membentuk ikatan kovalen. Struktur Lewis dari molekul MF4 adalah sebagai berikut.
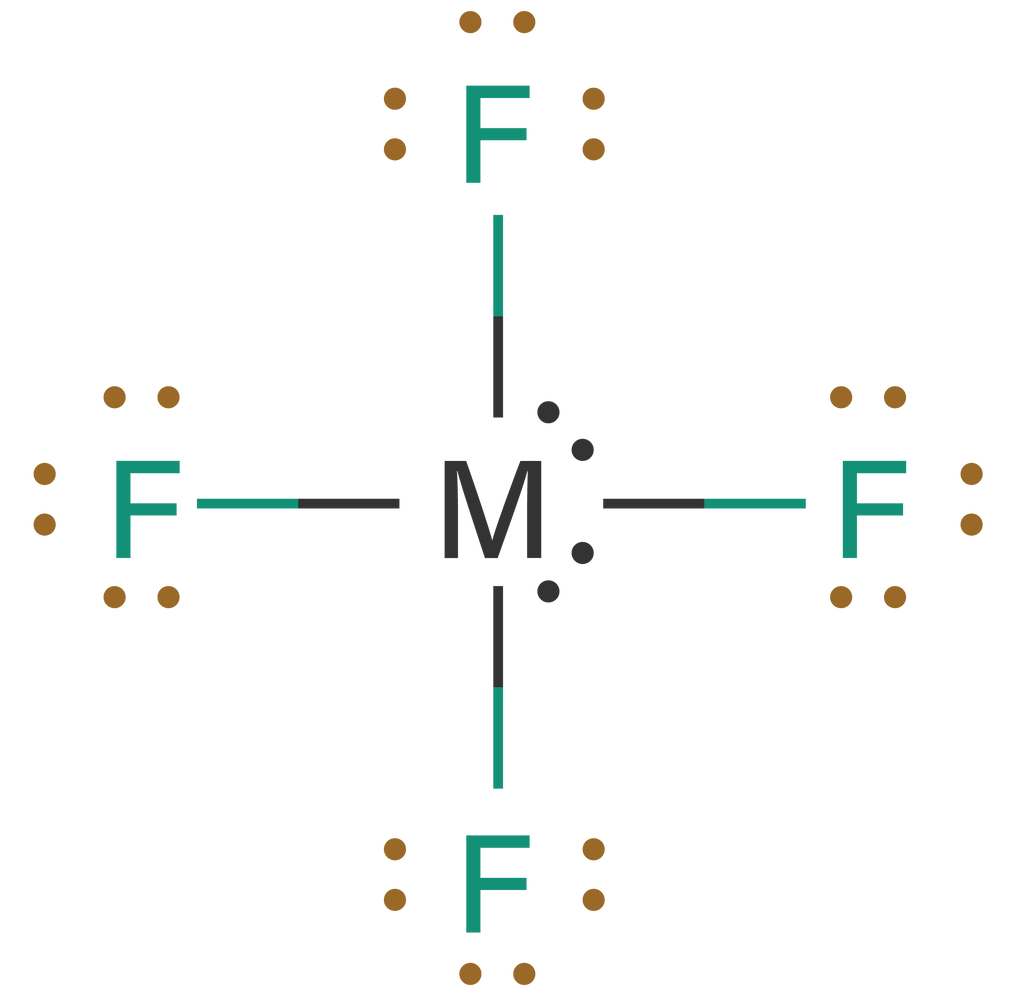
Berdasarkan struktur Lewis di atas, terlihat bahwa setiap atom F berikatan kovalen dengan 1 buah elektron dari atom M, sehingga terbentuk 4 buah ikatan kovalen tunggal dan terbentuk 4 pasangan elektron ikatan (PEI). Atom M sebagai atom pusat masih memiliki 4 buah atau 2 pasang elektron bebas (PEB) yang tidak digunakan untuk berikatan. Dengan demikian, maka tipe molekulnya dituliskan sebagai AX4E2. Senyawa yang memiliki tipe molekul AX4E2 akan memiliki geometri molekul yang berbentuk segi empat planar. Bentuk molekul segi empat planar yang simetris menyebabkan molekul MF4 akan bersifat nonpolar.
Dengan demikian, maka bentuk molekul dan sifat kepolaran molekul MF4 adalah segi empat planar dan nonpolar.
Jadi, jawaban yang tepat adalah B.
















