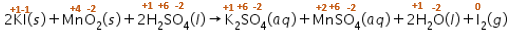Iklan
Pertanyaan
Tentukan reaksi berikut yang merupakan reaksi redoks. 2 KI ( s ) + MnO 2 ( s ) + 2 H 2 SO 4 ( l ) → K 2 SO 4 ( a q ) + MnSO 4 ( a q ) + 2 H 2 O ( l ) + I 2 ( g )
Tentukan reaksi berikut yang merupakan reaksi redoks.
Iklan
BR
B. Rohmawati
Master Teacher
Mahasiswa/Alumni Universitas Negeri Semarang
Jawaban terverifikasi
12
0.0 (0 rating)
Iklan
Pertanyaan serupa
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia