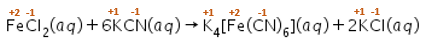Iklan
Pertanyaan
Tentukan reaksi berikut yang merupakan reaksi redoks. FeCl 2 ( a q ) + 6 KCN ( a q ) → K 4 [ Fe ( CN ) 6 ] ( a q ) + 2 KCl ( a q )
Tentukan reaksi berikut yang merupakan reaksi redoks.
Iklan
BR
B. Rohmawati
Master Teacher
Mahasiswa/Alumni Universitas Negeri Semarang
Jawaban terverifikasi
1
0.0 (0 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia