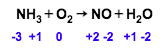Cara penyetaraan persamaan reaksi dengan cara perubahan bilangan oksidasi, yaitu dengan cara melihat perubahan bilangan oksidasinya. Penyetaraan dilakukan dengan menyamakan perubahan bilangan oksidasi. Pada cara ini suasana reaksi tidak begitu mempengaruhi, meskipun suasana reaksi belum diketahui, penyetaraan dapat dilakukan.
1. Setarakan unsur yang mengalami perubahan biloks!
 sudah setara
sudah setara
2. Tentukan biloks masing-masing unsur yang mengalami perubahan biloks.
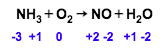
3. Tentukan perubahan biloks.
Atom yang mengalami oksidasi adalah atom N karena mengalami kenaikan bilangan oksidasi dari -3 ke +2 dan membebaskan elektron sebanyak 5 elektron dan atom yang mengalami reduksi adalah atom O karena mengalami penurunan bilangan oksidasi dari 0 ke -2 dan menangkap elektron sebanyak 2.
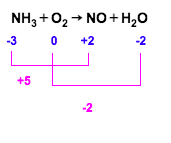
4. Samakan kedua pelepasan dan penangkapan elektron
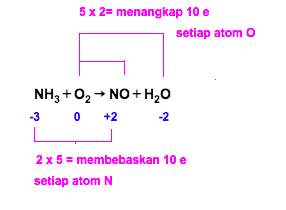
5. Menyetarakan atom N dengan mengalikan dengan angka 2
Agar ekuivalen dengan membebaskan sebanyak 10 elektron maka atom N masing-masing ruas dikalikan 2.

6. Menyetarakan atom O
Setiap 1 atom O menangkap 2 elektron maka diperlukan 5 atom O untuk menangkap 10 elektron, maka koefisien  di ruas kiri dikalikan 2,5.
di ruas kiri dikalikan 2,5.

Pada ruas kiri jumlah atom O adalah 5 dan ruas kanan 3, agar setara jumlah atom O-nya maka koefisien  dikalikan 3 menjadi:
dikalikan 3 menjadi:

Reaksi dikalikan 2 agar koefisien tidak berbentuk pecahan:

Jadi reaksi setaranya adalah: