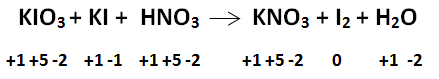Langkah pertama tentukan biloks masing-masing spesi tiap senyawa.
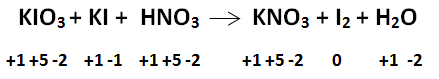
Atom I mengalami kenaikan dan penurunan bilangan oksidasi. Atom I pada  mengalami reduksi karena terjadi penurunan biloks dari +5 menjadi 0. Atom I pada KI mengalami oksidasi karena terjadi kenaikan biloks dari -1 menjadi 0. Reaksi ini disebut reaksi konproporsionasi. Selanjutnya penyetaraan reaksi redoks dapat dilakukan dengan metode setengah sel.
mengalami reduksi karena terjadi penurunan biloks dari +5 menjadi 0. Atom I pada KI mengalami oksidasi karena terjadi kenaikan biloks dari -1 menjadi 0. Reaksi ini disebut reaksi konproporsionasi. Selanjutnya penyetaraan reaksi redoks dapat dilakukan dengan metode setengah sel.
- Reaksi reduksi

Tuliskan reaksi setengah sel reaksi oksidasi  .
.

Karena K tidak mengalami perubahan bilangan oksidasi atau ion spektator maka atom K dapat dihilangkan.

Kemudian kalikan 2 untuk ion  untuk menyetarakan jumlah atom I. Selanjutnya tambahkan
untuk menyetarakan jumlah atom I. Selanjutnya tambahkan  pada ruas sebelah kanan untuk menyamakan jumlah atom oksigen. Lalu tambahkan 6 ion
pada ruas sebelah kanan untuk menyamakan jumlah atom oksigen. Lalu tambahkan 6 ion  di ruas kiri untuk menyamakan jumlah atom hidrogen. Terakhir, tambahkan 4 elektron di sebelah kiri untuk menyamakan muatan di kedua ruas.
di ruas kiri untuk menyamakan jumlah atom hidrogen. Terakhir, tambahkan 4 elektron di sebelah kiri untuk menyamakan muatan di kedua ruas.

Tuliskan reaksi setengah sel reaksi reduksi HI.

Karena K tidak mengalami perubahan bilangan oksidasi atau ion spektator maka atom K dapat dihilangkan.

Kemudian kalikan ion  dengan dua untuk menyamakan atom iodin. Lalu, tambahkan 2 elektron di ruas kanan untuk menyamakan jumlah muatan di kedua ruas.
dengan dua untuk menyamakan atom iodin. Lalu, tambahkan 2 elektron di ruas kanan untuk menyamakan jumlah muatan di kedua ruas.

- Penyetaraan dan eliminasi jumlah elektron
Untuk menyamakan jumlah elektron sehingga dapat dieliminasi maka kedua reaksi perlu dikalikan dengan bilangan tertentu. Reaksi reduksi dikalikan satu sedangkan reaksi oksidasi dikalikan dua untuk mengeliminasi elektron.

Dengan demikian, reaksi redoks yang setara untuk soal di atas adalah  .
.
Jadi, jawaban yang benar adalah
 .
.