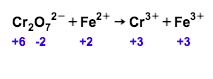Iklan
Pertanyaan
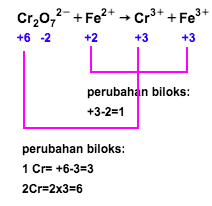
Salin dan setarakan persamaan ion berikut dengan cara setengah reaksi dan cara perubahan bilangan oksidasi dalam suasana asam! Cr 2 O 7 2 − + Fe 2 + → Cr 3 + + Fe 3 +
Salin dan setarakan persamaan ion berikut dengan cara setengah reaksi dan cara perubahan bilangan oksidasi dalam suasana asam!
Iklan
L. Avicenna
Master Teacher
Mahasiswa/Alumni Institut Teknologi Bandung
7
4.5 (41 rating)
ihsan ibrahim
Pembahasan lengkap banget Ini yang aku cari! Mudah dimengerti Bantu banget Makasih ❤️
Yuan Nisa
Makasih ❤️
DIMAS
Makasih ❤️
Lisa Nur Rohmawati
Mudah dimengerti walaupun sangat panjang Makasih ❤️
Samuel Fernando S
Makasih ❤️ Mudah dimengerti Pembahasan lengkap banget Ini yang aku cari! Bantu banget
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia