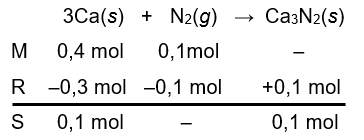Iklan
Pertanyaan
Sebanyak 16 glogam kalsium bereaksi dengan 2,8 ggas nitrogen menghasilkan kalsium nitrida menurut persamaan reaksi berikut. Ca ( s ) + N 2 ( g ) → Ca 3 N 2 ( s ) (belum setara) Berdasarkan reaksi tersebut, massa kalsium nitrida yang dihasilkan adalah .... ( A r N = 14 dan Ca = 40)
Sebanyak 16 g logam kalsium bereaksi dengan 2,8 g gas nitrogen menghasilkan kalsium nitrida menurut persamaan reaksi berikut.
(belum setara)
Berdasarkan reaksi tersebut, massa kalsium nitrida yang dihasilkan adalah .... ( N = 14 dan Ca = 40)
14,8 g
29,6 g
44,4 g
59,2 g
74,0 g
Iklan
MR
M. Rizki
Master Teacher
Jawaban terverifikasi
2
5.0 (3 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia