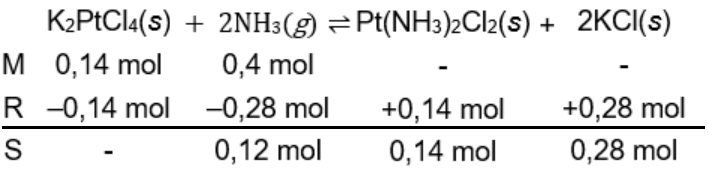Iklan
Pertanyaan
Cis -platin merupakan senyawa antikanker dan dapat disintesis dengan cara mereaksikan 58,1 g K 2 PtCl 4 dengan 6,8 gamonia berdasarkan persamaan reaksi (belum setara) berikut. K 2 PtCl 4 ( s ) + NH 3 ( g ) → Pt ( NH 3 ) 2 Cl 2 ( s ) + KCl ( s ) Jika reaksi berlangsung sempurna, massa reaktan yang tersisa sebanyak .... ( A r H = 1, N = 14, Cl = 35,5, K = 39, dan Pt = 195)
Cis-platin merupakan senyawa antikanker dan dapat disintesis dengan cara mereaksikan 58,1 g dengan 6,8 g amonia berdasarkan persamaan reaksi (belum setara) berikut.
Jika reaksi berlangsung sempurna, massa reaktan yang tersisa sebanyak ....
( H = 1, N = 14, Cl = 35,5, K = 39, dan Pt = 195)
1,08 g
2,04 g
3,06 g
4,02 g
4,20 g
Iklan
YR
Y. Rochmawatie
Master Teacher
Jawaban terverifikasi
1
0.0 (0 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia