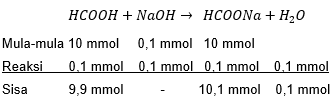Larutan penyangga (buffer) adalah larutan yang dapat mempertahankan pH. Larutan buffer dapat dibuat dengan cara melalui reaksi kimia atau tanpa reaksi kimia. Larutan penyangga asam mengandung asam lemah dan basa konjugasinya yang dalam hal ini basa konjugasinya disediakan oleh garam. Pada soal di atas, larutan terdiri dari asam lemah HCOOH dan garam HCOONa, sehingga termasuk dalam larutan penyangga asam.
a. pH awal larutan
Larutan penyangga HCOOH/HCOONa dapat ditentukan pH-nya dengan rumus pH penyangga asam. Mula-mula dicari mol dari asam lemah dan garam.
n HCOOH===M×V0,1 M×100 mL10 mmol
n HCOONa===M×V0,1 M×100 mL10 mmol
Rumus pH penyangga asam yaitu :
[H+]pH======Ka×mol garammol asam lemah10−5×10 mmol10 mmol10−5 M−log [H+]−log 10−55
pH awal larutan adalah 5
b. pH setelah ditambah 1 mL HCl 0,1 M
Larutan penyangga HCOOH/HCOONa terdiri atas asam lemah HCOOH dan basa konjugasi HCOO− yang disediakan oleh garam HCOONa. Maka, saat penambahan asam, komponen basa konjugasi yang akan bereaksi dengan larutan asam yang ditambahkan.
Mol asam HCl yang ditambahkan yaitu :
n HCl=M×V =0,1 M×1 ml =0,1 mmol
Maka, reaksi yang terjadi adalah

[H+]pH=========Ka×mol basa konjugasimol asam lemahKa×mol HCOO−mol HCOOH10−5×9,9 mmol10,1 mmol10−5×1,021,02×10−5 M−log [H+]−log 1,02×10−55−log 1,024,99
pH larutan setelah penambahan asam adalah 4,99
c. pH setelah ditambah 1 mL NaOH 0,1 M
Saat penambahan basa, maka komponen asam lemah HCOOH yang akan bereaksi dengan larutan basanya.
Mol basa yang ditambahkan yaitu :
n NaOH=M×V =0,1 M×1 ml =0,1 mmol
Maka, reaksi yang terjadi adalah
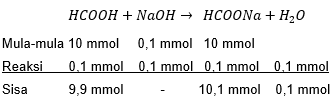
[H+]pH=========Ka×mol basa konjugasi/garammol asam lemahKa×mol HCOONamol HCOOH10−5×10,1 mmol9,9 mmol10−5×0,989,8×10−6 M−log [H+]−log 9,8×10−66−log 9,85,008
pH setelah penambahan basa adalah 5,008
Jadi, nilai pH awal larutan adalah 5, setelah penambahan asam menjadi 4,99 dan setelah penambahan basa menjadi 5,008.