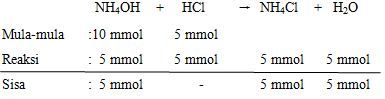Iklan
Pertanyaan
Sebanyak 100 mL larutan amonia dalam air ( NH 3 + H 2 O ) yang pH-nya 11 dengan Kb sebesar 1 , 0 × 1 0 − 5 direaksikan dengan 50 mL larutan asam klorida (HCl) yang pH-nya 1. Setelah dicampurkan, maka pH larutan tersebut menjadi ....
Sebanyak 100 mL larutan amonia dalam air yang pH-nya 11 dengan Kb sebesar direaksikan dengan 50 mL larutan asam klorida (HCl) yang pH-nya 1. Setelah dicampurkan, maka pH larutan tersebut menjadi ....
Iklan
Q'
Q. 'Ainillana
Master Teacher
Mahasiswa/Alumni Universitas Negeri Yogyakarta
Jawaban terverifikasi
1
5.0 (1 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia