Iklan
Pertanyaan
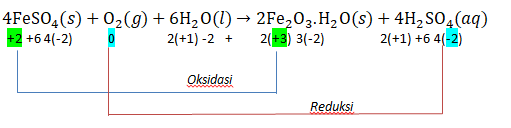
Polusi udara mengandung oksida belerang yang dapat mempercepat terjadinya korosi besi sesuai persamaan berikut: Fe ( s ) + SO 2 ( g ) + O 2 ( g ) → FeSO 4 ( s ) 4 FeSO 4 ( s ) + O 2 ( g ) + 6 H 2 O ( l ) → 2 Fe 2 O 3 . H 2 O ( s ) + 4 H 2 SO 4 ( a q ) Tentukan bilangan oksidasi semua atom/unsur yang terlibat dalam kedua reaksi redoks di atas! Identifikasikan beberapa unsur yang mengalami oksidasi atau reduksi!
Polusi udara mengandung oksida belerang yang dapat mempercepat terjadinya korosi besi sesuai persamaan berikut:
- Tentukan bilangan oksidasi semua atom/unsur yang terlibat dalam kedua reaksi redoks di atas!
- Identifikasikan beberapa unsur yang mengalami oksidasi atau reduksi!
Iklan
BR
B. Rohmawati
Master Teacher
Mahasiswa/Alumni Universitas Negeri Semarang
Jawaban terverifikasi
4
4.6 (5 rating)
TS
Tiara Simbolon
Pembahasan lengkap banget
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia