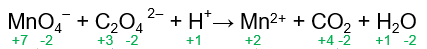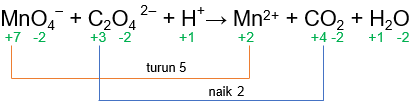Soal tersebut dapat diselesaikan dengan menggunakan penyetaraan reaksi redoks dengan menggunakan metode setengah reaksi dalam suasana asam. Langkah pengerjaan soal adalah sebagai berikut.
Langkah 1: menentukan zat yang mengalami reduksi dan oksidasi
Sebelum menentukan zat yang mengalami reduksi dan oksidasi, bilangan oksidasi masing-masing zat dalam senyawa pada reaksi tersebut harus diketahui terlebih dahulu. Bilangan oksidasi masing-masing zat adalah sebagai berikut.
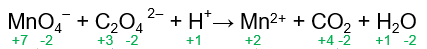
Perubahan bilangan oksidasi zat adalah sebagai berikut.
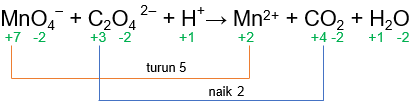
Berdasarkan gambar di atas, unsur Mn mengalami penurunan biloks (reduksi) dan unsur C mengalami kenaikan biloks (oksidasi).
Langkah 2: menuliskan persamaan setengah reaksi reduksi dan setengah reaksi oksidasi
Persamaan setengah reaksi reduksi dan setengah reaksi oksidasi adalah sebagai berikut.
reduksi: MnO4−→Mn2+oksidasi: C2O42−→CO2
Langkah 3: menyetarakan reaksi redoks
Penyetaraan dimulai dari menyamakan jumlah unsur yang mengalami perubahan biloks.
reduksi: MnO4−→Mn2+oksidasi: C2O42−→2CO2
Selanjutnya jumlah atom O disetarakan dengan penambahan H2O pada sisi yang kekurangan atom O.

Jumlah atom H dapat disetarakan dengan penambahan H+ (suasana asam).

Selanjutnya penambahan elektron dilakukan untuk penyetaraan muatan.

Persamaan reaksi lengkapnya dapat ditentukan dengan menjumlahkan reaksi dan mengeliminasi elektron. Elektron pada masing-masing reaksi dapat dieliminasi apabila jumlahnya sudah sama sehingga pada reaksi reduksi koefisiennya perlu dikalikan 2 dan pada reaksi oksidasi perlu dikalikan 5 pada koefisiennya. Persamaannya menjadi sebagai berikut.

Persamaan reaksi lengkapnya menjadi sebagai berikut.

Dengan demikian nilai a = 2, b = 5, c = 16, dan d = 10.
Jadi, jawaban yang paling tepat adalah opsi D.