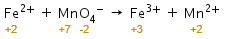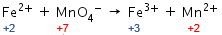Penyetaraan reaksi redoks dengan metode biloks dalam suasana asam adalah sebagai berikut.
Langkah 1: menghitung biloks setiap unsur.
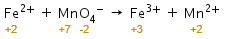
Langkah 2: mengidentifikasi unsur yang mengalami perubahan biloks.
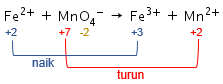
Langkah 3: menyamakan jumlah unsur yang mengalami perubahan biloks, yaitu unsur Fe dan Mn.
Pada reaksi ini, jumlah unsur Fe dan Mn di ruas kiri dan kanan sudah sama sehingga tidak ada perubahan koefisien.
Langkah 4: menghitung total biloks unsur yang mengalami perubahan biloks dengan cara dikalikan dengan indeks atau koefisien unsur.
Karena jumlah unsur Fe dan Mn pada ruas kiri dan kanan adalah 1, maka total biloks masing-masing unsur dikalikan 1.
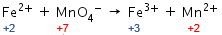
Langkah 5: menghitung total perubahan biloks pada reaksi.
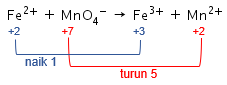
Langkah 6: menyamakan total perubahan biloks pada reaksi.
Kenaikan biloks unsur Fe adalah 1, sedangkan penurunan biloks unsur Mn adalah 5. Agar total perubahan biloksnya sama, maka cari kelipatan antara 1 dan 5, yaitu 5. Dengan demikian, kenaikan biloks unsur Fe dikalikan 5 dan penurunan biloks unsur Mn dikalikan 1.
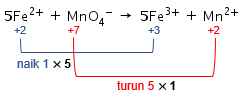
Angka faktor pengali 5 menjadi pengali koefisien dari zat yang mengandung unsur Fe, sedangkan angka faktor pengali 1 menjadi pengali koefisien dari zat yang mengandung unsur Mn.
Langkah 7: menyamakan jumlah muatan dengan menambah ion  pada ruas yang muatannya lebih kecil.
pada ruas yang muatannya lebih kecil.
Muatan pada ruas kiri adalah +9, sedangkan muatan pada ruas kanan adalah +17. Maka, tambahkan 8 ion  pada ruas kiri sehingga persamaan reaksinya menjadi
pada ruas kiri sehingga persamaan reaksinya menjadi

Langkah 8: menyamakan jumlah oksigen dengan menambahkan  pada ruas yang kekurangan oksigen.
pada ruas yang kekurangan oksigen.
Terdapat 4 atom O pada ruas kiri saja. Artinya, di ruas kanan kurang 4 atom O sehingga perlu menambahkan 4  . Persamaan reaksinya menjadi
. Persamaan reaksinya menjadi

Langkah 9: memeriksa kembali reaksi setara.


Dengan demikian, jumlah ion  yang terlibat adalah 8.
yang terlibat adalah 8.
Jadi, jawaban yang tepat adalah C.