Iklan
Pertanyaan
Perhatikan tiga buah larutan dalam tiga beaker berikut: Tiga gelas beaker di atas masing-masing sebanyak 25 mL mengandung HCl , NH 3 , dan NH 4 Cl dengan konsentrasi 0,100 M pada suhu 25 ∘ C . Dalam gelas 3 terjadi reaksi: NH 4 + ( a q ) + H 2 O ( l ) ⇌ NH 3 ( a q ) + H 3 O + ( a q ) Hitunglah nilai K a untuk NH 4 + ( a q ) pada 25 ∘ C . Larutan dalam gelas 2 dituangkan ke dalam gelas 3 dan campuran larutan yang terbentuk dikocok-kocok. Anggaplah bahwa volumenya bertambah. Hitunglah pH larutan yang dihasilkan. Larutan dalam gelas 1dituangkan ke dalam larutan yang dibuat pada c(ii). Anggaplah bahwa volumenya bertambah. Campuran larutan yang terbentuk dikocok-kocok. Apakah larutan yang terbentuk merupakan larutan penyangga? Jelaskan! Hitunglah [ NH 4 + ] akhir pada 25 ∘ C .
Perhatikan tiga buah larutan dalam tiga beaker berikut:

Tiga gelas beaker di atas masing-masing sebanyak 25 mL mengandung dengan konsentrasi 0,100 M pada suhu .
- Dalam gelas 3 terjadi reaksi:
- Hitunglah nilai untuk pada .
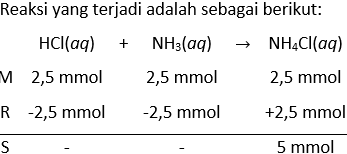
- Larutan dalam gelas 2 dituangkan ke dalam gelas 3 dan campuran larutan yang terbentuk dikocok-kocok. Anggaplah bahwa volumenya bertambah. Hitunglah pH larutan yang dihasilkan.
- Larutan dalam gelas 1 dituangkan ke dalam larutan yang dibuat pada c(ii). Anggaplah bahwa volumenya bertambah. Campuran larutan yang terbentuk dikocok-kocok.
- Apakah larutan yang terbentuk merupakan larutan penyangga? Jelaskan!
- Hitunglah akhir pada .
Iklan
Q'
Q. 'Ainillana
Master Teacher
Mahasiswa/Alumni Universitas Negeri Yogyakarta
Jawaban terverifikasi
1
5.0 (1 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia