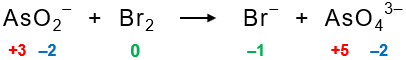Cara menyetarakan persamaan reaksi redoks ion menggunakan metode setengah reaksi dalam suasana basa sama dengan cara menyetarakan reaksi redoks ion dalam suasana asam. Namun, terdapat tambahan 1 langkah lagi, yaitu menambahkan ion OH− sebanyak jumlah ion H+ di kedua ruas/sisi. Langkah pengerjaannya adalah sebagai berikut.
Langkah 1: menentukan biloks masing-masing unsur
Biloks masing-masing unsur dapat ditentukan sebagai berikut.
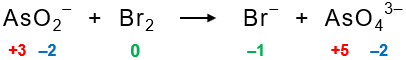
Langkah 2: memisahkan reaksi redoks menjadi 2 bagian
Reaksi redoks dipisahkan menjadi 2 bagian, yaitu oksidasi dan reduksi. Berdasarkan perubahan biloksnya, ion AsO2− mengalami oksidasi menjadi ion AsO43−, sedangkan molekul Br2 mengalami reduksi menjadi ion Br−.
oksidasireduksi::AsO2−Br2→→AsO43−Br−
Langkah 3: menyamakan jumlah unsur yang mengalami perubahan biloks
Jumlah unsur As yang teroksidasi di sisi kiri sama dengan jumlah unsur As di sisi kanan. Namun, jumlah unsur Br yang tereduksi di sisi kiri tidak sama dengan jumlah unsur Br di sisi kanan. Agar jumlah unsur Br di kedua sisi sama, koefisien ion Br− menjadi 2.
oksidasireduksi::AsO2−Br2→→AsO43−2Br−
Langkah 4: menyamakan jumlah oksigen
Sisi yang kekurangan oksigen ditambahkan dengan molekul H2O sebagai berikut.
oksidasireduksi::AsO2−+2H2OBr2→→AsO43−2Br−
Langkah 5: menyamakan jumlah hidrogen
Sisi yang kekurangan hidrogen ditambahkan dengan ion H+ sebagai berikut.
oksidasireduksi::AsO2−+2H2OBr2→→AsO43−+4H+2Br−
Langkah 6: menyamakan jumlah muatan
Elektron ditambahkan pada sisi dengan jumlah muatan yang lebih besar (positif) sebagai berikut.
oksidasireduksi::AsO2−+2H2OBr2+2e−→→AsO43−+4H++2e−2Br−
Langkah 7: menyamakan elektron di kedua reaksi
Oleh karena jumlah elektron di kedua reaksi sudah sama, koefisien zat di kedua sisi tidak perlu dikali dengan bilangan apapun. Kedua reaksi bisa langsung dijumlahkan sebagai berikut.

Langkah 8: menambahkan ion  di kedua sisi
di kedua sisi
Oleh karena reaksi redoks berlangsung dalam suasana basa, ion OH− ditambahkan di kedua sisi sesuai dengan jumlah ion H+ sebagai berikut.
AsO2−+Br2+2H2O+4OH−→AsO43−+2Br−+4H++4OH−
Ion H+ akan bergabung dengan ion OH− membentuk air (H2O) sehingga air di kedua sisi dapat dieliminasi.

Dengan demikian, persamaan reaksi redoks yang telah setara adalah sebagai berikut.
AsO2−+Br2+4OH−→AsO43−+2Br−+2H2O
Jadi, jawaban yang benar adalah B.