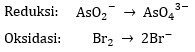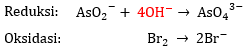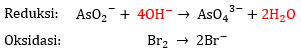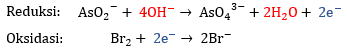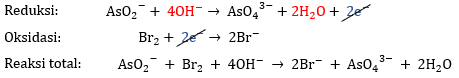Penyetaraan reaksi redoks dengan metode setengah reaksi dalam suasana basa, yaitu:
1) Menuliskan persamaan reaksi reduksi dan oksidasi
Reaksi reduksi disertai dengan penurunan biloks, sedangkan reaksi oksidasi disertai dengan kenaikan biloks.
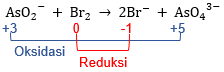
Tuliskan kedua reaksi secara terpisah.
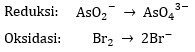
2) Menyetarakan atom utama (selain atom O dan H)
Pada reaksi reduksi, jumlah atom As pada ruas kiri dan ruas kanan sudah sama sehingga tidak ada perubahan koefisien. Begitu juga dengan atom Br pada reaksi oksidasi.
3) Menyetarakan atom O dan H
- Tambahkan 2n ion
 pada ruas yang kekurangan atom O.
pada ruas yang kekurangan atom O.
Pada reaksi reduksi, terdapat 2 atom O pada ruas kiri dan 4 atom O pada ruas kanan. Artinya, di ruas kanan kekurangan 2 atom O sehingga tambahkan ion  sebanyak 2n, yaitu 4 ion
sebanyak 2n, yaitu 4 ion  . Pada reaksi oksidasi, tidak terdapat atom O.
. Pada reaksi oksidasi, tidak terdapat atom O.
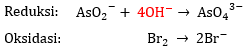
- Tambahkan
 pada ruas yang kekurangan atom H.
pada ruas yang kekurangan atom H.
Pada reaksi reduksi, terdapat 4 atom H pada ruas kiri dan 0 atom H pada ruas kanan. Artinya, di ruas kanan kekurangan 4 atom H sehingga perlu menambahkan 2  . Pada reaksi oksidasi, tidak terdapat atom H.
. Pada reaksi oksidasi, tidak terdapat atom H.
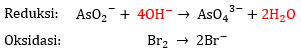
4) Menyetarakan jumlah muatan
Tambahkan elektron untuk menyetarakan ju,lah muatan di ruas kiri dan kanan.
Pada reaksi reduksi, muatan di ruas kiri adalah  5 dan muatan di ruas kanan adalah
5 dan muatan di ruas kanan adalah  3. Agar muatan pada kedua ruas menjadi
3. Agar muatan pada kedua ruas menjadi  5, maka tambahkan 2
5, maka tambahkan 2 pada ruas kanan.
pada ruas kanan.
Pada reaksi oksidasi, muatan di ruas kiri adalah 0 dan muatan di ruas kanan adalah  2. Agar muatan pada kedua ruas menjadi
2. Agar muatan pada kedua ruas menjadi  2, maka tambahkan 2
2, maka tambahkan 2 pada ruas kiri.
pada ruas kiri.
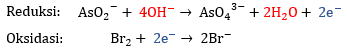
5) Menjumlahkan reaksi dengan mengeliminasi elektron
Karena jumlah elektron pada kedua reaksi sudah sama, yaitu 2 maka dapat langsung dieliminasi dan diperoleh reaksi akhir sebagai berikut.
maka dapat langsung dieliminasi dan diperoleh reaksi akhir sebagai berikut.
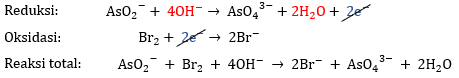
Jadi, jawaban yang tepat adalah opsi A.