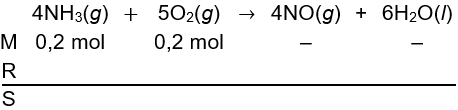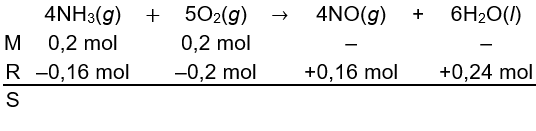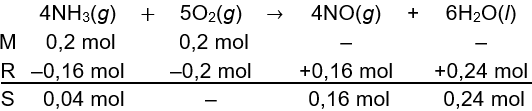Langkah pengerjaan untuk menyelesaikan soal adalah sebagai berikut.
Langkah 1: menyetarakan reaksi yang terjadi
Reaksi belum setara pada soal adalah sebagai berikut.
NH3(g)+O2(g)→NO(g)+H2O(l)
Agar reaksi tersebut setara, jumlah unsur pada reaktan dan produk harus disamakan, yaitu dengan menambah koefisien pada masing-masing spesi. Persamaan reaksi yang setara adalah sebagai berikut.
4NH3(g)+5O2(g)→4NO(g)+6H2O(l)
Langkah 2: menghitung mol mula-mula masing-masing reaktan
Hal yang diketahui di soal adalah jumlah partikel amonia (NH3) dan volume oksigen (O2) yang diukur pada kondisi RTP (Room Temperature and Pressure), yaitu pada tekanan 1 atm dan suhu 25 ∘C. Nilai mol mula-mula dari amonia dan oksigen dapat dihitung dengan persamaan berikut.

Dengan demikian, nilai mol masing-masing gas NH3 dan O2 pada kondisi mula-mula adalah 0,2 mol.
Langkah 3: membuat persamaan stoikiometris
Pada kondisi mula-mula terdapat 0,2 mol NH3 dan 0,2 mol O2, sedangkan produk belum terbentuk (−).
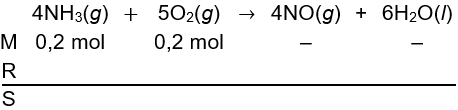
Selanjutnya, zat di reaktan yang bertindak sebagai pereaksi pembatas (habis bereaksi) perlu ditentukan terlebih dahulu. Zat yang bertindak sebagai pereaksi pembatas mempunyai nilai koefisienmol yang paling kecil.

Oleh karena O2 mempunyai nilai koefisienmol yang paling kecil, O2 bertindak sebagai pereaksi pembatas. Dengan demikian, O2 yang bereaksi adalah 0,2 mol. Lalu, mol NH3 yang bereaksi serta mol NO dan H2O yang terbentuk dapat dihitung dengan menggunakan konsep perbandingan mol dan koefisien.
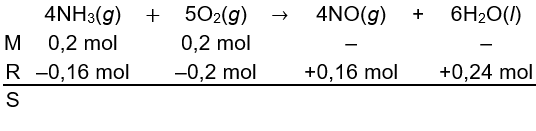
Setelah itu, mol zat di reaktan yang bersisa dan mol zat di produk yang terbentuk adalah sebagai berikut.
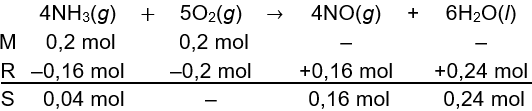
Langkah 4: menghitung mol total gas di akhir reaksi
Mol total gas di akhir reaksi dapat dihitung menggunakan persamaan berikut.
n totaln totaln total===n NH3(g)+n NO(g)0,04 mol+0,16 mol0,20 mol
Dengan demikian, mol total gas di akhir reaksi sebesar 0,2 mol.
Jadi, jawaban yang tepat adalah C.