Iklan
Pertanyaan
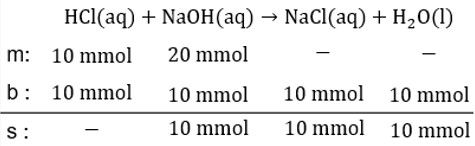
Perhatikan persamaan termokimia berikut. HCl ( a q ) + NaOH ( a q ) → NaCl ( a q ) + H 2 O ( l ) △ H = − 54 kJ Berapakah perubahan entalpi jika 10 ml HCI 1 M direaksikan dengan 20 ml NaOH 1 M?
Perhatikan persamaan termokimia berikut.
Berapakah perubahan entalpi jika 10 ml HCI 1 M direaksikan dengan 20 ml 1 M?
Iklan
AA
A. Acfreelance
Master Teacher
Jawaban terverifikasi
13
4.7 (7 rating)
SD
Sabina Dwi Rahmadhani
Pembahasan lengkap banget Makasih ❤️
AA
Aisya Azzahra
Makasih ❤️
FZ
Fadillah Zubair Rafsanjani
Makasih ❤️ Mudah dimengerti
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia