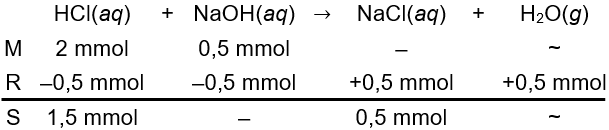Iklan
Pertanyaan
Pada kondisi standar, 1 mol gas HCl dialirkan ke dalam air membentuk 1 L larutan. Selanjutnya, diambil 10 mL dan dicampurkan dengan larutan NaOH 0.5 M sebanyak 1 mL. Jika hanya 20% saja gas HCl yang dapat larut dan nilai Δ H n 0 HCl sebesar − 57.5 kJ/mol, jumlah kalor yang dilepaskan saat penetralan sebesar ....
Pada kondisi standar, 1 mol gas HCl dialirkan ke dalam air membentuk 1 L larutan. Selanjutnya, diambil 10 mL dan dicampurkan dengan larutan NaOH 0.5 M sebanyak 1 mL. Jika hanya saja gas HCl yang dapat larut dan nilai
575 J
115 J
28.75 kJ
28.75 J
115 kJ
Iklan
PO
P. Osara
Master Teacher
Jawaban terverifikasi
2
0.0 (0 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia