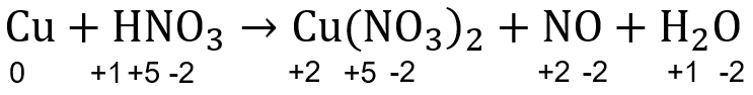Soal tersebut dapat diselesaikan menggunakan konsep penyetaraan reaksi redoks molekuler metode biloks. Langkah pengerjaannya adalah sebagai berikut.
Langkah 1: menentukan biloks masing-masing unsur
Biloks masing-masing unsur ditentukan terlebih dahulu menggunakan aturan biloks sehingga didapatkan sebagai berikut.
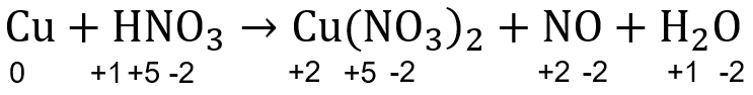
Langkah 2: mengidentifikasi unsur yang mengalami perubahan biloks
Berdasarkan langkah 1, diketahui biloks unsur Cu naik dari 0 menjadi +2 sehingga unsur Cu mengalami oksidasi. Biloks unsur N juga berubah, yaitu turun dari +5 menjadi +2 sehingga unsur N mengalami reduksi.
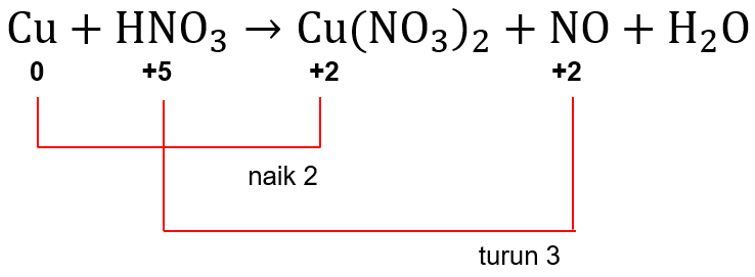
Langkah 3: menyamakan jumlah unsur yang mengalami perubahan biloks
Jumlah unsur Cu di sisi kiri sama dengan jumlah unsur Cu di sisi kanan pada senyawa Cu(NO3)2, yaitu sama-sama 1. Jumlah unsur N di sisi kiri pada HNO3 sama dengan jumlah unsur N di sisi kanan pada senyawa NO. Ingat ya! unsur N yang dihitung di sisi kanan hanya pada unsur NO karena biloks N berubah, sedangkan biloks unsur N pada senyawa Cu(NO3)2 tetap (sama biloksnya dengan unsur N di sisi kiri). Dengan demikian, jumlah unsur yang mengalami perubahan biloks di kedua sisi sudah sama.
Langkah 4: menyamakan total perubahan biloks pada reaksi
Berdasarkan langkah 2, total kenaikan biloks Cu adalah 2, sedangkan total penurunan biloks N adalah 3. Agar total perubahan biloksnya sama, kedua nilai perubahan biloks dikalikan dengan angka kelipatan terkecil antara 2 dan 3, yaitu 6. Dengan demikian, total perubahan biloks Cu dikalikan dengan 3, sedangkan total perubahan biloks N dikalikan dengan 2.
Angka faktor pengali 3 akan menjadi pengali koefisien dari zat yang mengandung unsur Cu, sedangkan angka faktor pengali 2 akan menjadi pengali koefisien dari zat yang mengandung unsur N. Dengan demikian, persamaan reaksinya dapat dituliskan sebagai berikut.
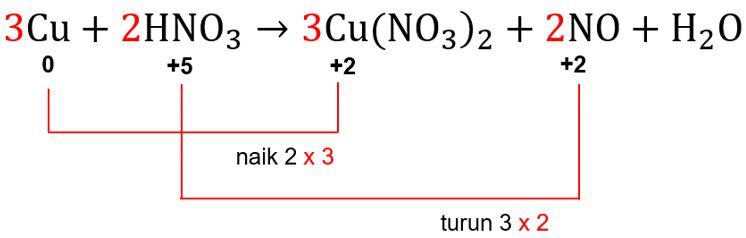
Langkah 5: menyamakan jumlah unsur yang belum sama selain oksigen dan hidrogen
Jumlah unsur yang belum sama adalah unsur N. Pada sisi kiri terdapat 2 atom N, sedangkan di sisi kanan terdapat 8 atom N. Agar jumlah atom N sama maka senyawa HNO3 di sisi kiri diubah koefisiennya menjadi 8.

Langkah 6: menyamakan jumlah unsur oksigen dan hidrogen
Jumlah unsur H di sisi kiri sebanyak 8, sedangkan di sisi kanan sebanyak 2. Agar jumlah unsur H sama, senyawa H2O di sisi kanan dikalikan dengan 4.

Dengan demikian, persamaan reaksi redoksnya sudah setara.
Jadi, jawaban yang tepat adalah opsi C.