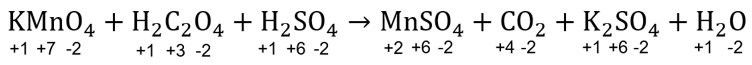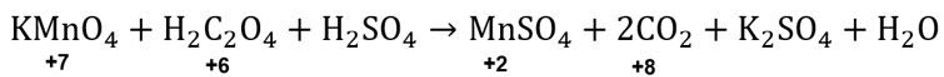Langkah penyetaraan reaksi redoks pada soal dalam suasana asam menggunakan metode biloks adalah sebagai berikut.
Langkah 1: menentukan biloks setiap unsur dalam senyawa
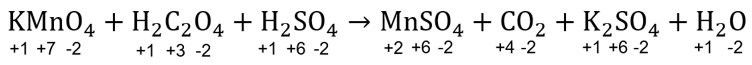
Langkah 2: mengidentifikasi unsur-unsur yang mengalami perubahan biloks
Unsur yang mengalami perubahan biloks adalah Mn dan C. Unsur Mn mengalami penurunan biloks dari +7 menjadi +2, sedangkan unsur C mengalami kenaikan biloks dari +3 menjadi +4.
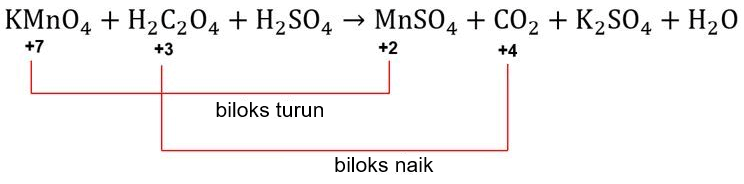
Langkah 3: menyamakan jumlah unsur yang mengalami perubahan biloks
Jumlah unsur Mn di reaktan dan produk sudah sama, yaitu 1. Lalu, jumlah unsur C di reaktan ada 2, sedangkan di produk ada 1. Agar jumlah unsur C sama, CO2 di produk perlu ditambahkan koefisien 2. Reaksinya menjadi seperti berikut.
KMnO4+H2C2O4+H2SO4→MnSO4+2CO2+K2SO4+H2O
Langkah 4: menghitung total biloks unsur yang mengalami perubahan biloks
Total biloks dihitung dari biloks unsur dikalikan dengan jumlah unsurnya (dilihat dari indeks atau koefisien unsur). Total biloks unsur Mn di reaktan maupun di produk sama dengan biloksnya masing-masing, sedangkan total biloks unsur C di reaktan dan produk masing-masing dikalikan 2.
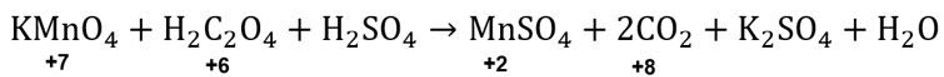
Langkah 5: menghitung total perubahan biloks
Biloks unsur Mn turun dari +7 menjadi +2 sehingga total perubahan biloksnya adalah 5, sedangkan biloks unsur C naik dari +6 menjadi +8 sehingga total perubahan biloksnya adalah 2.
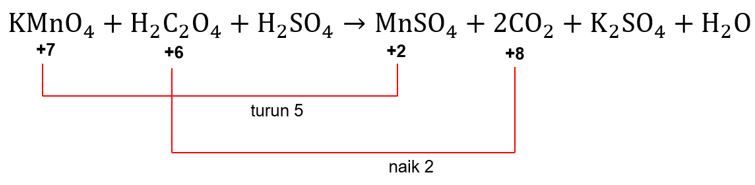
Langkah 6: menyamakan total perubahan biloks
Agar total perubahan biloks unsurnya sama, total perubahan biloks unsurnya perlu disetarakan dengan mencari nilai kelipatan terkecil antara 2 dan 5, yaitu 10.
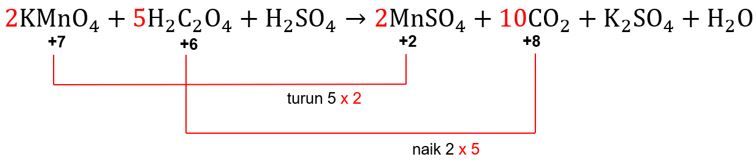
Angka faktor pengali 2 akan menjadi pengali koefisien dari zat yang mengandung unsur Mn, sedangkan angka faktor pengali 5 akan menjadi pengali koefisien dari zat yang mengandung unsur C.
Langkah 7: menyamakan jumlah unsur selain O dan H
Jumlah unsur yang belum sama adalah unsur S. Unsur S di reaktan ada 1, sedangkan di produk ada 3. Agar jumlah unsur S sama, H2SO4 di reaktan harus diberi koefisien 3.
2KMnO4+5H2C2O4+3H2SO4→2MnSO4+10CO2+K2SO4+H2O
Langkah 8: menyamakan jumlah unsur O
Unsur O di reaktan ada 40, sedangkan di produk ada 32 (O dari H2O tidak dihitung). Jumlah unsur O disetarakan dengan menambah H2O. Oleh karena itu, H2O di produk perlu diberi koefisien 8.
2KMnO4+5H2C2O4+3H2SO4→2MnSO4+10CO2+K2SO4+8H2O
Langkah 9: memeriksa kembali persamaan reaksi akhir
Jumlah unsur di reaktan dan produk sudah sama sehingga reaksi sudah setara. Dengan demikian, hasil persamaan reaksi yang disetarakan dalam suasana asam adalah sebagai berikut.
2KMnO4+5H2C2O4+3H2SO4→2MnSO4+10CO2+K2SO4+8H2O
Jadi, jawaban yang tepat adalah B.