Iklan
Pertanyaan
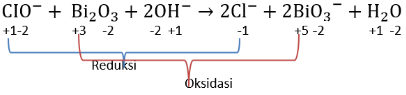
Perhatikan persamaan reaksi redoks berikut: CIO − + Bi 2 O 3 + 2 OH − → 2 Cl − + 2 BiO 3 − + H 2 O Tentukan Oksidator dan Reduktor dari reaksi tersebut!
Perhatikan persamaan reaksi redoks berikut:
Tentukan Oksidator dan Reduktor dari reaksi tersebut!
Iklan
NP
N. Puspita
Master Teacher
Jawaban terverifikasi
3
3.6 (3 rating)
TS
TIARA SITA DEWI
Makasih ❤️
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia