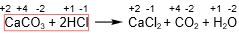Konsep reaksi redoks yang melibatkan perpindahan elektron ini hanya bisa terjadi pada senyawa ionik aja, sedangkan senyawa kovalen tidak. Oleh karena itu, muncul konsep redoks yang ketiga, yaitu berdasarkan perubahan bilangan oksidasi (biloks).
Bilangan oksidasi adalah muatan positif dan negatif pada suatu atom. Unsur yang biloksnya positif, biasanya merupakan atom-atom unsur logam, seperti Na, Fe, Mg, Ca, dan unsur logam lainnya. Sementara itu, unsur yang biloksnya negatif, biasanya atom-atom unsur nonlogam, seperti O, Cl, F, dan unsur nonlogam lainnya.
Berdasarkan konsep perubahan bilangan oksidasi, reaksi reduksi adalah reaksi yang mengalami penurunan bilangan oksidasi. Sedangkan reaksi oksidasi adalah reaksi yang mengalami kenaikan bilangan oksidasi. Sementara itu zat yang mengalami reduksi disebut oksidator dan sebaliknya zat yang mengalami oksidasi disebut reduktor,
Terdapat delapan aturan dalam menentukan bilangan oksidasi suatu atom yang harus Sobat ketahui, antara lain adalah sebagai berikut.
- Bilangan oksidasi atom dalam unsur bebas adalah 0
- Bilangan oksidasi ion monoatomik sama dengan muatan
- Bilangan oksidasi F dalam senyawa selalu -1
- Bilangan oksidasi O dalam senyawa maupun ion adalah -2, kecuali dalam senyawa peroksida (-1) dan superoksida (−21)
- Bilangan oksidasi H selalu +1, kecuali ketika berikatan dengan logam menjadi -1
- Dalam senyawa unsur golongan IA, IIA dan alumunium mempunyai biloks beruturut-turut +1, +2, dan +3
- Jumlah bilangan oksidasi atom dalam senyawa adalah 0
- Dalam senyawa unsur yang memiliki keleektronegatifan lebih besar memiliki bilangan oksidasi negatif
- Jumlah bilangan oksidasi semua atom dalam ion poliatomik sama dengan muatannya
Untuk menentukan reduktor dan oksidator pertama kita perlu mencari biloks atom dari setiap senyawa baik sebelum maupun sesudah reaksi.
1.
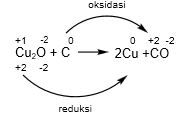
Cu2O mengalami reduksi maka Cu2O sebagai oksidator, sedangkan C sebagai reduktor.
Jadi, oksidator dan reduktor dari reaksi tersebut adalah Cu2O dan unsur C
2.
dari reaksi tersebut tidak ada perubahan bilangan oksidasi dari masing-masing atom. Artinya reaksi tersebut bukan reaksi redoks.
Jadi, tidak ada oksidator dan reduktor pada reaksi tersebut, karena reaksi tersebut bukan reaksi redoks
3.
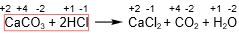
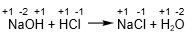
dari reaksi tersebut tidak ada perubahan bilangan oksidasi dari masing-masing atom. Artinya reaksi tersebut bukan reaksi redoks.
Jadi, tidak ada oksidator dan reduktor pada reaksi tersebut, karena reaksi tersebut bukan reaksi redoks
4.
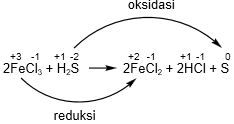
Dari reaksi tersebut FeCl3 mengalami reduksi, maka FeCl3 sebagai oksidator. Sedangkan H2S mengalami oksidasi, maka H2S sebagai reduktor.
Jadi, oksidator dan reduktor dari reaksi tersebut berturut-turut adalah FeCl3 dan H2S
5.
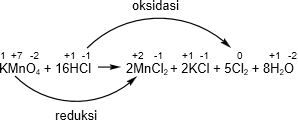
Dari reaksi di atas KMnO4 mengalami reaksi reduksi, maka KMnO4 sebagai oksidator. Sedangkan HCl mengalami reaksi oksidasi, maka HCl sebagai reduktor.
Jadi, oksidator dan reduktor dari reaksi tersebut berturut-turut adalah KMnO4 dan HCl