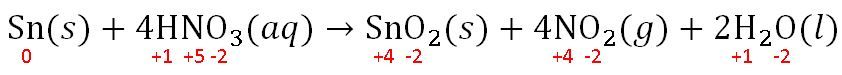Iklan
Pertanyaan
Perhatikan persamaan reaksi redoks berikut. Sn ( s ) + 4 HNO 3 ( a q ) → SnO 2 ( s ) + 4 NO 2 ( g ) + 2 H 2 O ( l ) Bilangan oksidasi dari zat oksidator dan hasil reduksinya berturut-turut adalah ...
Perhatikan persamaan reaksi redoks berikut.
Bilangan oksidasi dari zat oksidator dan hasil reduksinya berturut-turut adalah ...
Iklan
B. Rohmawati
Master Teacher
Mahasiswa/Alumni Universitas Negeri Semarang
3
4.7 (24 rating)
Shally Alfatiya
Pembahasan lengkap banget Ini yang aku cari! Mudah dimengerti Bantu banget Makasih ❤️
Inndadzil Arsy
Pembahasan lengkap banget Ini yang aku cari! Mudah dimengerti Bantu banget Makasih ❤️
Muhammad Mauladdawilah
Ini yang aku cari!
Zaki Arya
Pembahasan lengkap banget
Gracia Epiphania Simanjuntak
Bantu banget
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia