Iklan
Pertanyaan
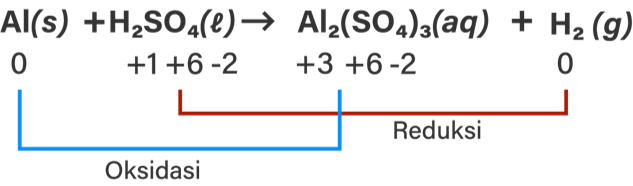
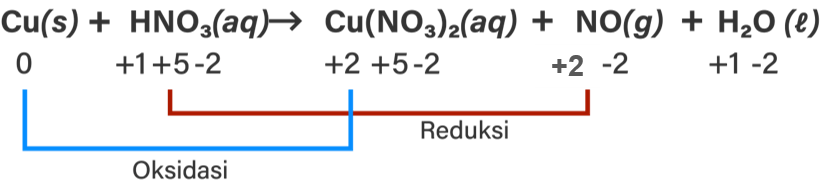
Perhatikan persamaan reaksi kimia berikut: CaCO 3 ( s ) + HCl → CaCl 2 ( s ) + CO 2 ( g ) + H 2 O ( l ) Al ( s ) + H 2 SO 4 ( a q ) → Al 2 ( SO 4 ) 3 ( a q ) + H 2 ( g ) Cu ( s ) + HNO 3 ( a q ) → Cu ( NO 3 ) 2 ( a q ) + NO ( g ) + H 2 O ( l ) Dari ketiga persamaan reaksi kimia di atas: Tentukan yang merupakan persamaan reaksi redoks! Untuk persamaan reaksi yang termasuk reaksi redoks, tentukan unsur yang mengalami oksidasi dan reduksi serta perubahan bilangan oksidasinya! Tentukan oksidator dan reduktornya pada persamaan reaksi redoks tersebut!
Perhatikan persamaan reaksi kimia berikut:
Dari ketiga persamaan reaksi kimia di atas:
- Tentukan yang merupakan persamaan reaksi redoks!
- Untuk persamaan reaksi yang termasuk reaksi redoks, tentukan unsur yang mengalami oksidasi dan reduksi serta perubahan bilangan oksidasinya!
- Tentukan oksidator dan reduktornya pada persamaan reaksi redoks tersebut!
Iklan
DV
D. Vitama
Master Teacher
Mahasiswa/Alumni Universitas Islam Negeri Sunan Kalijaga
Jawaban terverifikasi
2
2.0 (6 rating)
PJ
Petra Juliansen Manullang
Jawaban tidak sesuai
KG
Kluban Godong Pring
Jawaban tidak sesuai Pembahasan tidak menjawab soal
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia