Iklan
Pertanyaan
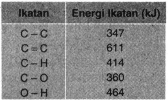
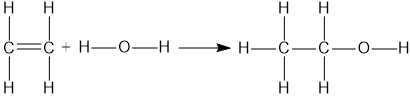
Perhatikan kedua tabel berikut! Tabel Data Energi Ikatan Rata-rata Tabel Data Perubahan Entalpi Pembentukan Standar Hitunglah: Perubahan entalpi yang terlibat dalam pembuatan etanol dari etena dan air berdasarkan energi ikatan rata-rata dan data perubahan entalpi pembentukan standar! Apakah kedua cara tersebut menghasilkan total energi yang sama atau berbeda? Mengapa demikian?
Perhatikan kedua tabel berikut!
Tabel Data Energi Ikatan Rata-rata
Tabel Data Perubahan Entalpi Pembentukan Standar
Hitunglah:
- Perubahan entalpi yang terlibat dalam pembuatan etanol dari etena dan air berdasarkan energi ikatan rata-rata dan data perubahan entalpi pembentukan standar!
- Apakah kedua cara tersebut menghasilkan total energi yang sama atau berbeda? Mengapa demikian?
Iklan
IS
I. Solichah
Master Teacher
Jawaban terverifikasi
1
0.0 (0 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia