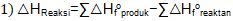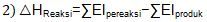Iklan
Pertanyaan
Dengan menggunakan hukum Hess dan definisi perubahan entalpi pembentukan standar serta energi ikatan, buktikan dengan satu contoh persamaan reaksi bahwa:
Dengan menggunakan hukum Hess dan definisi perubahan entalpi pembentukan standar serta energi ikatan, buktikan dengan satu contoh persamaan reaksi bahwa:
Iklan
IS
I. Solichah
Master Teacher
Jawaban terverifikasi
11
4.0 (2 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia