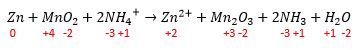Reaksi redoks merupakan reaksi reduksi dan oksidasi. Berdasarkan perubahan bilangan oksidasinya (biloks). Reaksi reduksi adalah reaksi yang ditandai dengan penurunan biloks, sedangkan reaksi oksidasi ditandai dengan kenaikan biloks. Salah satu ciri yang bisa dilihat untuk mengetahui reaksi redoks adanya unsur bebas. Spesi yang mengalami oksidasi disebut reduktor, sedangkan spesi yang mengalami reduksi disebut oksidator.
Untuk mengetahui, perubahan bilangan oksidasi nya, maka perlu ditentukan biloks dari masing-masing unsur pada setiap senyawa. Bilangan oksidasi pada masing-masing senyawa ditentukan berdasarkan aturan berikut:
- Tentukan terlebih dahulu oksidasi (biloks) setiap atom menurut aturan berikut:
- Biloks unsur bebas = 0
- Dalam senyawa: biloks golongan IA = +1, IIA = +2, Al = +3, H = +1 (kecuali pada hidrida logam, biloks H = -1), F = -1, O = -2 (kecuali pada peroksida, biloks O = -1 dan superoksida, biloks O = −1/2)
- Jumlah biloks ion = muatannya
- Jumlah biloks pada senyawa netral = 0
Berdasarkan penjelasan di atas, maka pada reaksi di bawah ini:
Menghitung biloks dari masing-masing unsur
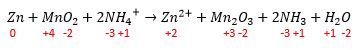
Sehingga
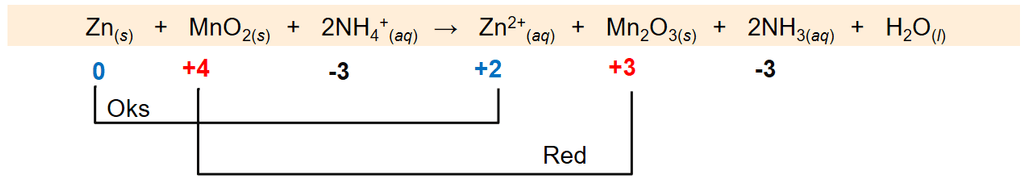
Dari reaksi diatas diketahui bahwa  mengalami oksidasi (kenaikan bilangan oksidasi), dan
mengalami oksidasi (kenaikan bilangan oksidasi), dan  mengalami reduksi (penurunan bilangan oksidasi).
mengalami reduksi (penurunan bilangan oksidasi).
Jadi, yang berperan sebagai eduktor (zat yang mengalami oksidasi) =  , dan yang berperan sebagai oksidator (zat yang mengalami reduksi) =
, dan yang berperan sebagai oksidator (zat yang mengalami reduksi) =